Введение. Поиск новых природных источников антиоксидантов, используемых как для пищевых, так и для косметических и лекарственных продуктов, является актуальной задачей в настоящее время. Растительное сырье, содержащее в своем составе многокомпонентный комплекс биологически активных веществ, представляет в этом плане несомненный интерес. Известно, что листья черной смородины отличаются высоким содержанием витаминов, микроэлементов, биофлавоноидов и представляют собой хороший источник природных антиоксидантов [1]. Для обеспечения высокого выхода биологически активных веществ из растительного сырья целесообразно использовать наиболее распространенный в промышленности метод многократной экстракции.
Целью данной работы являлось получение густых экстрактов листьев черной смородины, исследование их состава и антиоксидантных свойств.
Экспериментальная часть. В качестве экстрагентов использовали ацетон (ε=20,7) и гексан (ε=1,89) [2]. Экстрагирование проводили методом мацерации с последующей отгонкой растворителей на вакуумном испарителе и сушкой полученных субстанций до постоянного веса. Вытяжки представляли собой мазеобразные гомогенные системы темно-зеленого цвета с характерным запахом листьев черной смородины. Оставшиеся шроты были повторно обработаны растворителями следующим образом: листья, оставшиеся после вытяжки ацетоном, повторно обрабатывали гексаном (ГЭША), а листья, после экстракции гексаном – ацетоном (АЭШГ). Данные по выходу экстрактов представлены в таблице 1. Изучение состава полученных экстрактов проводили спектроскопическими методами: электронной и ИК-спектроскопии с Фурье-преобразованием. Для анализа готовили из густых экстрактов таблетки с бромидом калия (KBr). Спектры регистрировали на ИК-Фурье-спектрофотометре Avatar 360 (Nicolet) в диапазоне волновых чисел 4000–400 см-1. Электронные спектры получали на спектрофотометре VARIAN Cory в диапазоне длин волн 800–200 нм. Об антиоксидантной активности экстрактов судили по их способности ингибировать аутоокисление адреналина in vitro [3, 4] и тем самым предотвращать образование активных форм кислорода. Антиоксидантную активность рассчитывали как относительную величину и определяли соотношением оптических плотностей при определенном времени протекания реакции по формуле:
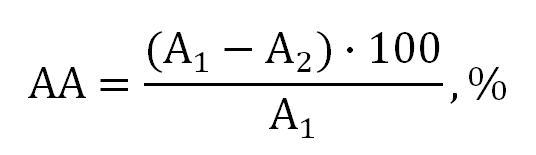 где А1, А2 – оптические плотности растворов адреналина в отсутствии и в присутствии экстрактов соответственно.
где А1, А2 – оптические плотности растворов адреналина в отсутствии и в присутствии экстрактов соответственно.
Результаты и их обсуждение.
С ростом величины диэлектрической проницаемости органического растворителя выход экстрактивных веществ возрастает. Полученные результаты согласуются с литературными данными, в которых показано, что более полярные растворители (например, этилацетат и изопропанол) извлекают из коры березы полифенолы, дубильные вещества и сахара. Увеличение полярности растворителя при переходе от этилацетата к изопропанолу и воде способствует росту концентрации полифенолов и дубильных веществ в выделенных экстрактах и мало влияет на содержание сахаров [5, 6]. Из экспериментальных данныхтакже видно, что при экстрагировании шротов выход снижается в 1,5-2 раза по сравнению с обработкой тем же растворителем исходного сырья.
Таблица 1 – Характеристика экстрактов
|
Экстракт |
Выход, % |
|
| 1 | Ацетоновый экстракт (АЭ) |
4,55 |
| 2 | Гексановый экстракт (ГЭ) |
2,06 |
| 3 | Ацетоновый экстракт шрота (АЭШГ) |
3,22 |
| 4 | Гексановый экстракт шрота (ГЭША) |
0,93 |
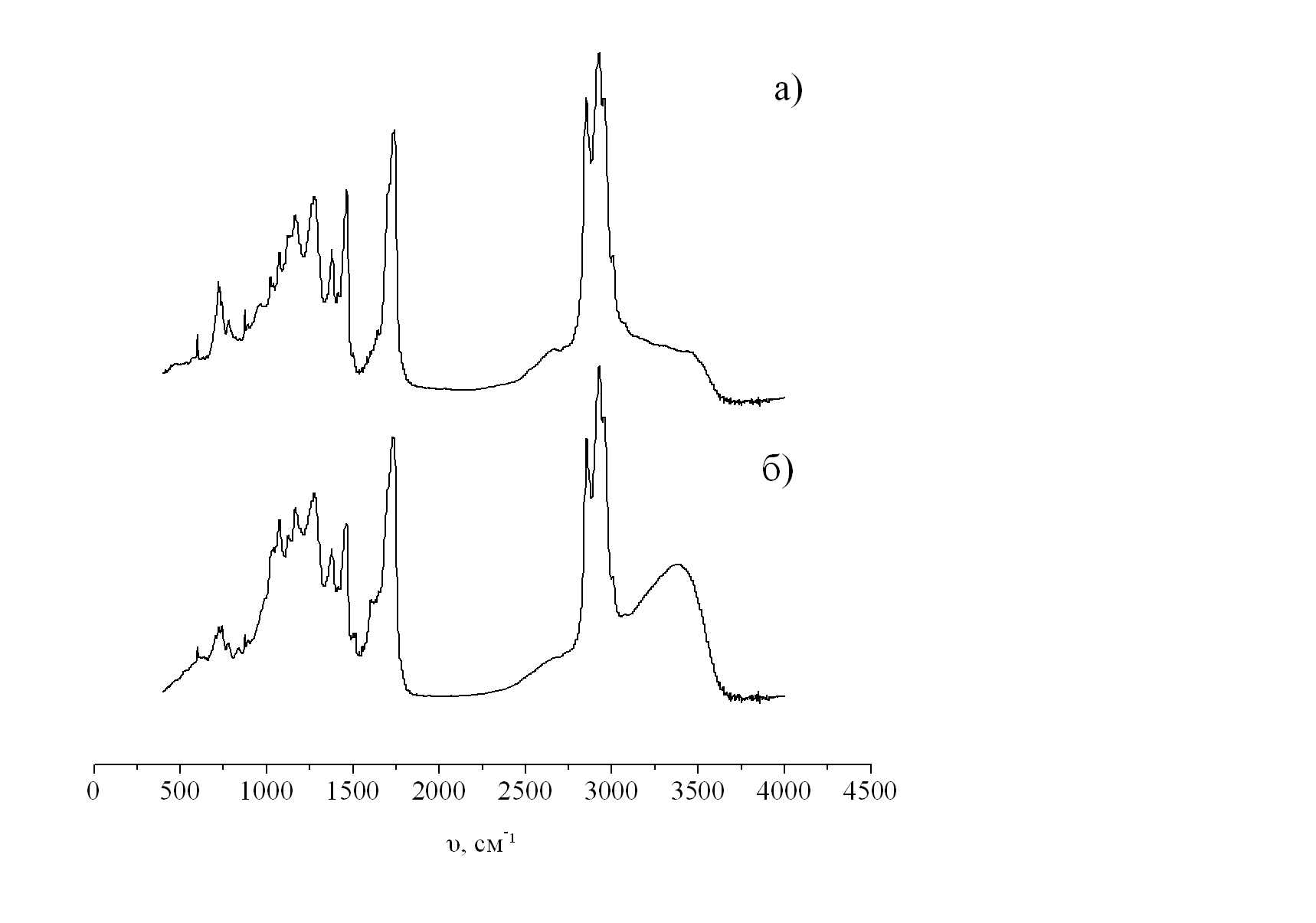
ИК-спектры экстрактов представлены на рисунках 1 и 2. Анализ ИК-спектров показывает значительное сходство полос поглощения экстрактов и позволяет выделить общие структурные элементы. Совокупность таких полос поглощений как ароматические связи (650-1000см-1, 1600-1620см-1), спиртовые гидроксилы (1050-1200 см-1), фенольные гидроксилы (1400см-1) карбонильные группы (1700-1720см-1), ассоциированные водородными связями гидроксилы (2500-3000см-1), валентные колебания гидроксильных групп (3200-3400см-1) однозначно указывает на присутствие в экстрактах фенольных соединений. ИК-спектр гексанового экстракта (рис. 1, а) отличается от спектра ацетонового (рис. 1, б) бо́льшим количеством гидроксильных групп, что следует из более выраженных пиков в соответствующем диапазоне. Также нельзя не отметить тот факт, что в ИК-спектрах экстрактов второй ступени экстракции сигналы в области 1100-1300 см-1 менее выражены, что может свидетельствовать о меньшем содержании в них фенольных соединений.
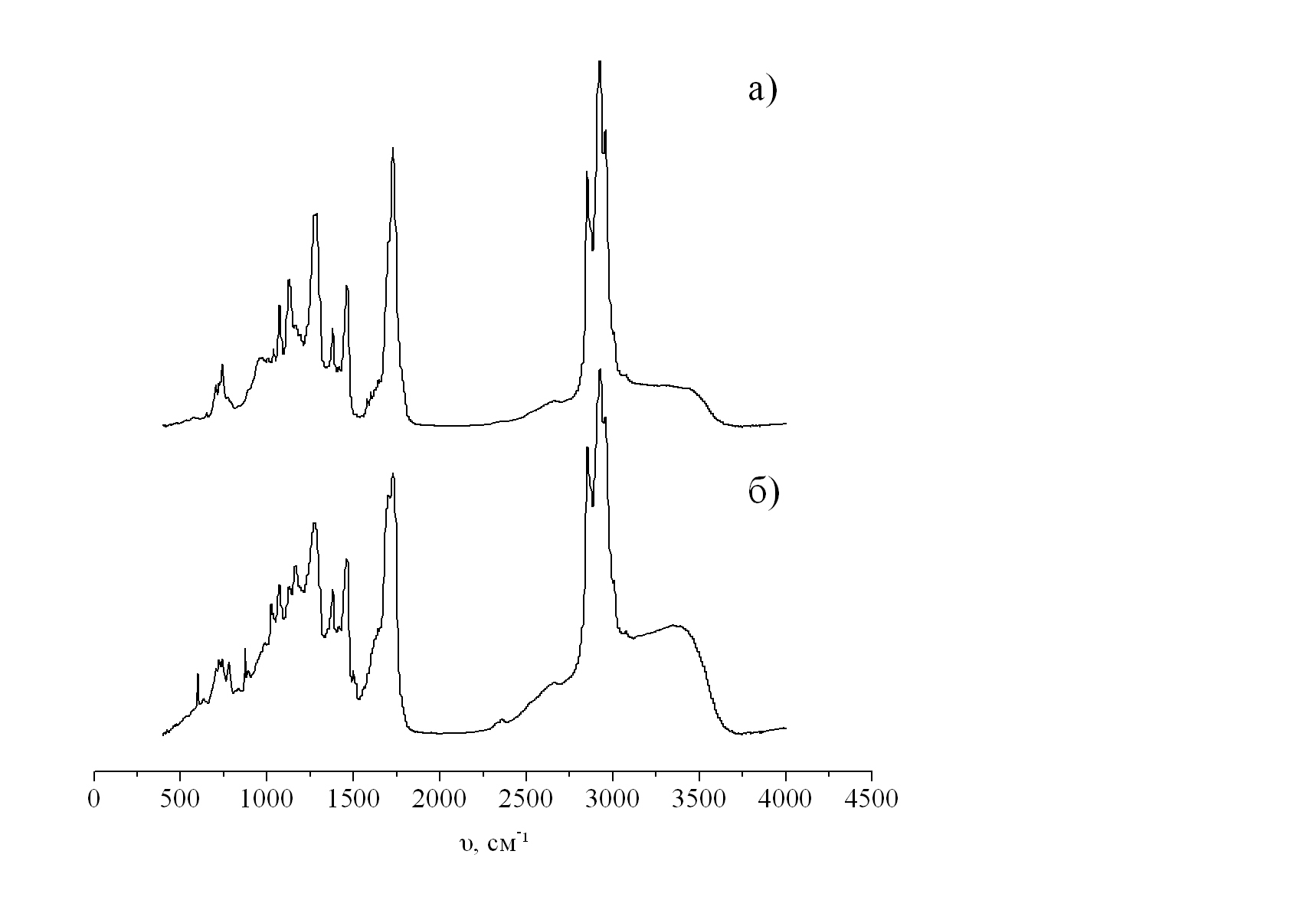 Рисунок 1. ИК-спектры экстрактов листьев черной смородины:
Рисунок 1. ИК-спектры экстрактов листьев черной смородины:
а – гексанового, б – ацетонового
Рисунок 2. ИК-спектры экстрактов шротов листьев черной смородины:
а – гексанового, б – ацетонового
На рисунке 3 представлены электронные спектры экстрактов листьев черной смородины. В спектре поглощения гексановых экстрактов обнаруживается пик при длинах волн 385–424 и 640–680 и плечи при 320–340 и 442–460 нм. Ацетоновые экстракты имеют выраженный максимум при 410–420 и 638–683, а также плечо при 420–440 нм. В соответствии с литературными данными в экстрактах листьев черной смородины были идентифицированы такие вещества, как хлорофиллы, каротиноиды, токоферолы и флавоноиды [7]. Можно отметить, что спектры экстрактов, полученных из исходного сырья, лежат выше спектров извлечений, полученных из шротов. Это свидетельствует о большем суммарном содержании биологически активных веществ в первых экстрактах по сравнению со вторыми.
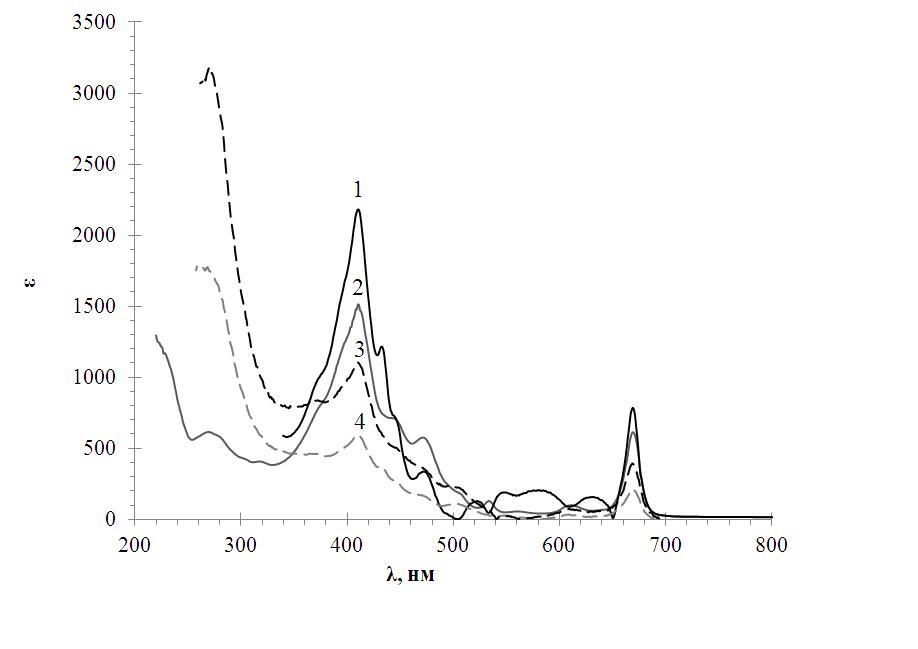 Рисунок 3. Спектры экстрактов:
Рисунок 3. Спектры экстрактов:
1 – АЭ; 2 – ГЭ; 3 – ГЭША; 4 – АЭШГ
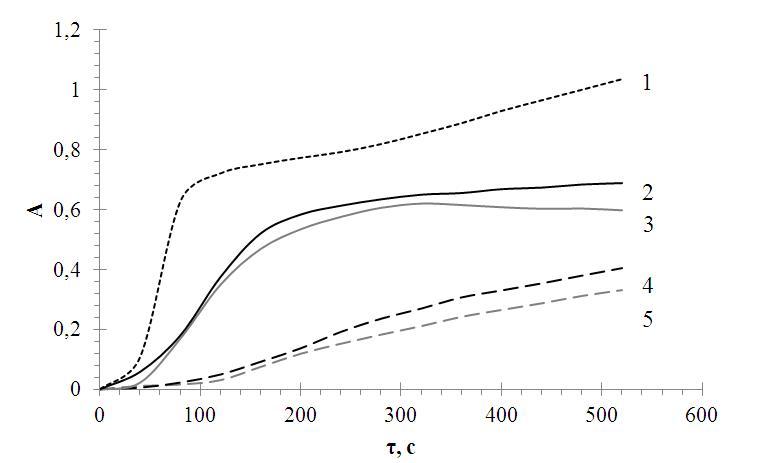
Антиокислительную активность экстрактов оценивали по реакции окисления адреналина в щелочной среде при длине волны 347 нм. На рисунке 4 представлена динамика реакции аутоокисления адреналина, имеющая сигмоидный характер.
Рисунок 4. Зависимость оптической плотности (А 347) от времени реакции аутоокисления адреналина в отсутствие (1) и в присутствии экстрактов:
2 – АЭШГ; 3 – ГЭША; 4 – АЭ; 5 – ГЭ
Ингибирующее действие рассматриваемых экстрактов проявляется в уменьшении нарастания значения оптической плотности в ходе процесса окисления по сравнению с контрольной пробой. Кинетические кривые окисления адреналина в присутствии ГЭША и АЭШГ лежат ниже контрольной кривой, что указывает на наличие в их составе веществ, проявляющих антиоксидантные свойства. Расчетные данные по антиоксидантной активности (АА) приведены в таблице 2.
Таблица 2 – Антиоксидантная активность экстрактов
|
Время, мин |
АА экстрактов, % |
|||
|
ацетонового (С=1,04∙10-4 г/мл) |
гексанового (С=9,73∙10-5г/мл) | |||
|
Экспериментальные значения |
В пересчете на единицу концентрации АА1·10-4 |
Экспериментальные значения |
В пересчете на единицу концентрации АА1·10-4 |
|
|
4 |
28,16 |
27,07 |
66,59 |
68,44 |
|
6 |
23,23 |
22,34 |
59,27 |
60,91 |
|
8 |
21,31 |
20,49 |
56,92 |
58,50 |
Величина АА более 10 % свидетельствует о наличии антиоксидантной активности. Большей антиоксидантной активностью обладает гексановый экстракт первой ступени экстракции (ГЭ). На начальном этапе окисления он уменьшает скорость окисления адреналина 18 раз, в то время как ацетоновый экстракт (АЭ) – в 11 раз. Меньшую активность проявили экстракты второй ступени, так ГЭША снизил скорость окисления в 10 раз, а АЭШГ – в 4 раза. С течением времени наблюдается уменьшение значений показателя ускорения в растворе сравнения, при этом в присутствии экстрактов он возрастает, что может свидетельствовать о расходовании веществ экстрактов, а следовательно о том, что снижение скорости окисления адреналина происходит за счет действия экстрактов.
Выводы. В настоящей работе получены густые экстракты листьев черной смородины с использованием в качестве экстрагентов гексана и ацетона. Спектрофотометрическими методами изучен их состав. Показано присутствие таких биологически активных веществ как хлорофиллы, каротиноиды и биофлавоноиды. Установлены антиоксидантные свойства на примере ингибирования реакции окисления адреналина. Наибольшей антиокислительной активностью обладает гексановый экстракт, превышая по этому показателю ацетоновый экстракт более чем в 2 раза.
Библиографический список
- Петрова С.Н., Кузнецова А.А. Состав плодов и листьев смородины черной Ribes nigrum / Химия растительного сырья. 2014. №4. С. 43-50.
- Волков И.М., Жарский А.И. Большой химический справочник / Мн.: Современная школа, 2005. 608 с.
- Сирота Т.В. Участие карбонат/бикарбонатных ионов в супероксидгенерирующей реакции автоокисления адреналина / Биомедицинская химия. 2015. том: 61(1). С. 115-124.
- Патент №2144674 (Россия). Способ определения антиоксидантной активности супероксидисмутазы и химических соединений / Т.В. Сирота / 20.01.2000.
- Nakajima Y., Sato Y., Konishi T. Antioxidant small phenolic ingredients in Inonotus obliguus (persoon) Pilat (Chaga) // Pharmaceutical society of Japan. 2007. V. 55. P. 1222-1226.
- Mazurkiewicz W. Analysis of aqueous extract of Inonotus obliguus//Acta Pol. Pharm. 2006. V. 63. P. 437—501
- Озимина И. И., Фролова О. О. Целенаправленный поиск биологически активных веществ в растениях // Современные проблемы науки и образования. 2013. № 1. С. 382-391.