Водород в небольших количествах используется в лабораторных целях и в автономных сварочных аппаратах. Для получения водорода в этих целях применяют, главным образом, электролиз воды и химическое вытеснение из водных растворов активными металлами. Недостатками этих методов являются сложность конструкции электролизера (в первом случае), неравномерная скорость образования водорода, использование дефицитных металлов и химическая агрессивность среды (во втором случае).
В то же время имеются химические соединения, которые при определенных условиях могут разлагаться с выделением водорода. Одним из таких соединений является гипофосфит натрия [1,2].Гипофосфит натрия широко применяется в качестве восстановителя при химическом никелировании и в различных химических синтезах. В водных растворах на поверхности металлов-катализаторов (Ni, Fе, Аl) разлагается с протеканием следующих реакции:
NaH2PO2+ H2O = NaH2PO3 + H2
NaH2PO3 + H2O = NaH2PO4 + H2
NaH2PO2 + 2H2O = NaH2PO4 + 2H2
Основными стадиями разложения гипофосфита натрия являются окисление гипофосфит-иона до фосфит или фосфат-иона и восстановление ионов водорода или молекул воды до газообразного водорода. При этом согласно данным [1,2], полученная молекула водорода состоит наполовину из водорода воды и наполовину водорода гипофосфита. Металлы, катализирующие процесс разложения гипофосфита, являются так же катализаторами выделения водорода.
Процесс разложения гипофосфита натрия является сопутствующей стадией при химическом никелировании [3]. Самопроизвольное протекание химического никелирования на никелевых, стальных и алюминиевых основахобъясняется их каталитическим воздействием на разложение ионов гипофосфита. При изучении физико-химических свойств пленок фосфида меди нанесенных на поверхности различных металлов и диэлектриков было найдено, что на этих пленках также происходит самопроизвольное химическое никелирование [4].
Исходя из этого, нами изучено разложение гипофосфита натрия на пленках фосфида меди, нанесенных на основы из различных материалов.
Изучение скорости выделения водорода проводили на гладких основах из никеля, алюминия и полихлорвинила, имеющих покрытия фосфида меди толщиной 0,5мкм и для сравнения на металлическом никеле. При получении пленок использовали технологию восстановления поверхностных пленок сульфата меди фосфином [4,5].
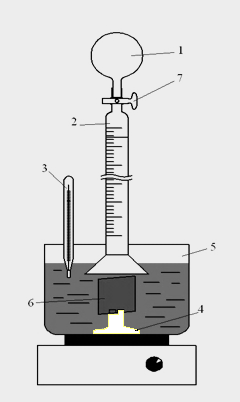
Исследования проводили на установке, позволяющей замерять объем выделяющегося водорода (рисунок 1), при температуре 90оС в растворе, содержащем 10 г/л NaH2PO2 ∙H2O. В качестве образцов использовали плоские пластины поверхностью 8 см2.
Рисунок 1- Схема установки для измерения объема выделившегося водорода в процессе разложения гипофосфита натрия
1-резиновая груша, 2-бюретка с делениями для измерения объема выделившегося водорода, 3-термометр, 4-приспособление для прикрепления образца, 5- термостатированный сосуд с исследуемым раствором, 6-образец, 7- краник
Из полученных данных видно (рисунок 2), что в одинаковых условиях, пленки фосфида меди, нанесенные на различные основы, значительно ускоряют выделение водорода при разложении гипофосфита натрия. Скорость выделения водорода на поверхности пленки фосфида меди, осажденной на гладкую основу, в несколько раз выше, чем на чистом никеле. Этот факт можно объяснить каталитическими свойствами фосфида меди к замедленной стадии выделения водорода. Из [2] следует, что выделение водорода из воды протекает легче, чем выделение водорода из гипофосфит-ионов.
Следует отметить, что заметную роль играет основа, на которой получена пленка фосфида меди. Возможно, здесь играет роль структура поверхностных частиц основы.
Таким образом, используя в качестве катализатора медь-фосфорные пленки, можно значительно (на порядок) ускорить процесс выделения водорода. Это позволяет использовать каталитическое разложение гипофосфита натрия для получения водорода в относительно небольших количествах.
Рисунок 2 – Влияние медь-фосфорных пленок на выделение водорода при разложении гипофосфита натрия
Обозначения кривых: 1 – никель; 2 – 4 – основы, покрытые медь-фосфорной пленкой: 2 – никель; 3 – алюминий; 4 – полихлорвинил
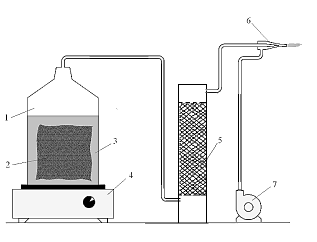
Этот способ был использован в лабораторной модели автономного сварочного аппарата(рисунок 3).
Получение катализаторов производилось путем металлизации пористых полимерных материалов. Этот выбор был обоснован тем что эти материалы имеют хорошо развитую поверхность, а также позволяют путем скручивания увеличить объем катализатора в реакционной среде.Материалы сначала обрабатывали в растворе CuSО4-H2О – 200-250 г/л, для создания слоя сульфата меди по всей поверхности материала. Затем высушивали при комнатной температуре в течение суток. При этом влага удаляется из пор, что обеспечивает газопроницаемость, необходимую при дальнейшем обработке фосфином. Обработку фосфином проводили в герметичной камере по методике, описанной в [6,7]. Высокоразвитая поверхность создает благоприятные условия для получения водорода в количестве необходимом для нормальной работы автономных сварочных аппаратов
Рисунок 3 – Установка для получения водорода
1 – емкость; 2 – катализатор; 3 – раствор гипофосфита натрия;
4 – нагреватель (плитка); 5 – влагоотделитель; 6 – сопло; 7 – компрессор
Опытный образец автономного сварочного аппарата имел высоту 10 см, диаметром 5 см, и диаметр сопла 0,5 мм. В сосуд помещался скрученный катализатор в виде металлизированной полимерной ткани 15×15 см2. Затем в сосуд наливали раствор, содержащий 200 г/л гипофосфита натрия. При помощи нагревательного элемента температура раствора доводилось, до 88-95°С. Полученный газ подавался в предварительную камеру сопла, куда при помощи микрокомпрессора подавали также воздух. Образующая водородно-кислородная смесь позволяла разрезать алюминиевые пластины толщиной 1-1,5 мм.
Для окончания работы достаточно выключить нагреватель. При охлаждении раствора электролита (ниже 40оС) выделение газа прекращалось полностью. Работоспособность электролита сохраняется до достижения концентрации NaH2PО2 – 200 мг/л.
Гипофосфит натрия является доступным, относительно недорогим продуктом. Так стоимость одноводного натрияфосфорноватистокислого марки «ч» (ГОСТ 200-76) составляет 167 руб/кг[8]. Теоретический расход на 1 литр водорода (н.у.) 2,4 г.
Таким образом, фосфид меди является эффективным катализатором, использование которого позволяет использовать разложение гипофосфита натрия для получения водорода в лабораторных целях и для автономных сварочных аппаратов.
Библиографический список
- Ван-Везер Фосфор и его соединения.-М, ИЛ, 1962.- 687 с.
- Д. КорбриджФосфор.-М:Мир, 1982.-680 с.
- С.А.Вишенков Химические и электротермохимические способы осаждения металлопокрытий.-М:Машиностроение, 1975.-312 с.
- М.С.Сатаев, К.К.Сырманова, А.С.Салыбаев Механизм химического никелирования основ, покрытых медь-фосфорными пленками. Известия ВУЗов Серия: Химия и химическая технология. Иваново, т.47 вып.4 2004г. стр.70-71
- T. SH. Koshkarbaeva, S.Z. Nauryzova, M.S. Sataev and A.B. Tleuova. Low-temperature Gas-phase Metallization of Dielectrics. Oriental journal of chemistry. 2012, Vol. 28, No. (3):Pg. 1281-1283
- M.S. Sataev, S.T. Koshkarbaeva, A.B. Tleuova, S. Perni, S.B. Aidarova, P. Prokopovich. Novel process for coating textile materials with silver to prepare antimicrobial fabrics //Colloids and Surfaces A: Physicochemical and Engineering Aspects. Volume 442, 1 February 2014, Pages 146–151
- М.С.Сатаев, Ш.Т.Кошкарбаева, А.Б.Тасболтаева. Металлизация изделий текстильной промышленности. Известия ВУЗов, Технология текстильной промышленности. Иваново, № 6 (348), 2013г. С. 102-104
- http://www.chem-service.com