Введение
В отличие от промышленных и бытовых отходов, химические отходы в университетских лабораториях образуются обычно в небольших количествах и представляют собой очень сложные смеси.
Согласно вузовским инструкциям рекомендуется отработанные растворы собирать независимо от их происхождения в закрывающийся стеклянный сосуд вместимостью не менее 3 л. После того как он наполнится на 4/5, проверяют рН и нейтрализуют при необходимости жидкость до рН 7-7,5 и выливают в канализацию с одновременной подачей воды. Так, неиспользуемые растворы дихромата калия разбавляют водопроводной водой до концентрации хрома 60 мг/л, добавляют известковое молоко 0,3-0,4 г/л и сульфата железа (II) 1 г/л [1].
Известно токсическое и канцерогенное действие этого вещества на человека, животных и рыб. Так, предельно допустимая концентрация (далее ПДК) для поверхностных вод для Cr (VI) 0,05 мг/л [2].
Для очистки сточных вод от хрома (VI) часто применяют ионообменные методы, они позволяют обеспечить высокую эффективность очистки[3].
Целью настоящей работы является – разработка методики очистки отходов химических реактивов от хромат-аниона.
Суть ионного обмена заключается в возможности катионитов и анионитов обменивать свои ионы на катионы и анионы, которые содержатся в водных растворах и сорбировать их из растворов. При этом иониты должны удовлетворять следующим требованиям: иметь высокую обменную емкость, устойчивость к кислотам, щелочам, окислителям, восстановителям, быть нерастворимыми в воде и растворах электролитов, иметь незначительное изменение объема.[4]
Иониты делят на катиониты и аниониты, проявляющие соответственно кислотные и основные свойства.[5] Важнейшим свойством ионитов является их обменная емкость – количество грамм-экв. ионов, которое может поглотить 1 м3 ионит до полного насыщения.
Очистка водных растворов содержащих соли хромовой кислоты возможна на сильноосновном анионите, например анионит АВ-17, АН-18Н, АН-25, АМ.
Аниониты AB-17 и AM представляют собой хлор метилированный сополимер стирола с ДБВ, аминированный триметиламином N(CH3)3, следующей структуры:
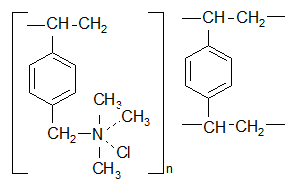
Рис.1 Структура анионита АВ17 и АМ
Пространственная углеводородная сетка называется матрицей, а обменивающиеся ионы, называются противоионами. Каждый противоион соединен с противоположно заряженными ионами, называемыми анкерными:
ROH + NaCl = RCl + NaOH
Ионообменный процесс проводили в динамических условиях – пропускали раствор через неподвижный слой сорбента в периодических процессах или противоточным движением раствора и сорбента в непрерывных процессах. Преимущества динамического способа – глубокая очистка раствора от примесей (благодаря контакту со свежими порциями сорбента) и полное использование обменной емкости слоя (вследствие увода потоком раствора продуктов из зоны реакции).
В лабораторных условиях исследовали адсорбцию хрома-аниона из водных растворов с помощью ионообменных смол (ионообменные смолы в ОН-форме). Эксперименты проводили в стеклянных колонках строго заданных размеров: 25 Ч 600 и 16 Ч 850 мм при полной регенерации.
Обменная емкость анионита не зависит от размера зерен, так как весь объем зерна доступен для ионообменной реакции.
Экспериментальная часть
Колонка для проведения ионного обмена представляет собой стеклянную бюретку на 50 мл, закрепленную в штативе, в узкую ее часть поместили стекловолокна, а затем заполняли анионитом АВ-17, в ОН-форме. [6] Анионит замачивали в небольшом количестве воды для набухания и легким постукиванием уплотняли в колонке.
Чаще всего в лабораториях используется водный раствор K2CrO4 с молярной концентрацией эквивалента 0,1 моль/л. Модельные растворы химических отходов содержащих Cr(VI) при рН=2, рН=7 и рН=9 готовили с концентрациями 2,5; 5,0; 7,5 мг/л. Для подкисления применяли смесь кислот (H2SO4 + H3PO4), для подщелачивания добавляли NaOH.
Определение содержания хрома (VI) фотоколориметрическим методом
Определение хромат-иона основано на реакции с дифенилкарбазидом, измерение оптической плотности проводили на КФК-3 при длине волны 540 нм, толщина кюветы 30 мм, использовали метод градуировочного графика.
Для построения градуировочного графика готовили серию стандартных растворов с концентрациями от 0,001 до 0,01 мг/л. В мерные колбы вместимостью 100 мл добавляли предварительно рассчитанные объемы стандартного раствора, затем смесь кислот 1:3 (H2SO4 + H3PO4) и 2 мл дифенилкарбазида и доводили объем раствора до метки. Полученные растворы через 5 минут фотометрировали на фотоэлетроколориметре. По результатам измерения оптической плотности строили градуировочный график и рассчитывали уравнение прямой.
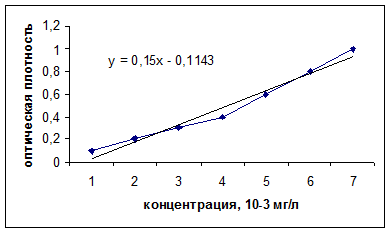
График 1 Зависимость концентрации раствора хлора от оптической плотности
Очистка водных растворов на анионите
Очистку проводили на анионите АВ-17 пропускали по 250 мл модельных растворов через колонку с анионитом со скоростью 10 мл/с. Масса сухого анионита составляла 15 г, объем набухшего анионита в колонке 57,75 мл. В очищенном растворе определяли концентрацию CrO42- и по уравнению прямой рассчитываем концентрацию.
Регенерация анионита
После пропускания через аниоитную колонку модельных растворов, ее промывают несколько раз дистиллированной водой и 10 % NaOH до значения рН=10-11. Затем собрали промывной раствор в мерную колбу, вместимостью 100 мл, для определения хрома: 1 мл раствора, содержащий хром (VI), 1 мл смеси кислот 1:3 (H2SO4 + H3PO4) перемешивали, добавляли 2 мл дифенилкарбазида и доводили объем раствора дистиллированной водой до метки. И через 5-10 мин фотометрировали на фотоэлектроколориметре.
Расчеты
Расчет полной обменной емкости
![]()
где: Vобщ – суммарный объем раствора, содержащий вытесненную из смолы щелочь, л; с – концентрация щелочи, моль/л; m – масса анионата
1. Определение концентрации хромат-иона в модельных растворах после очистки:
![]()
где: с – содержание CrO42-, найденное по градуировочному графику, мг/л; V – объем пробы взятой для анализа, мл.
степень очистки:
![]()
где: с0 – начальная концентрация хромат-иона, моль/л; ск – конечная концентрация хромат-иона, моль/л.
Определение концентрации хромат-ионов в промывных водах:
![]()
Определение величины адсорбции:
![]()
где: с0 – начальная концентрация хромат-иона, моль/л; ск – конечная концентрация хромат-иона, моль/л; масса анионита, г; V – объем раствора пропущенного через анионитную колонку, л.
Результаты
В таблице приведены экспериментальные данные по очистке модельных отходов химических реактивов, содержащих хромат-ион, путем ионообменной сорбции на анионите АВ-17. Получено, что содержание хромат-иона после пропускания через анионит всех изученных начальных концентрацией не превышает ПДК для поверхностных вод.
Таблица 1. Величины степеней очистки и адсорбции CrO42- на анионите АВ-17 при различных начальных концентрациях CrO42-в анализируемых водах.
| № п/п | Начальная концентрация с(СrO42-), мг/л | Концентрация после очистки с(СrO42-), мг/л | Степень очистки, % |
Адсорбция, ммоль/г |
| рН=2 | ||||
| 1 | 2,5 | 0,015 | 99,4 | 0,0414 |
| 2 | 5,0 | 0,032 | 99,4 | 0,0828 |
| 3 | 7,5 | 0,055 | 99,3 | 0,1241 |
| рН=7 | ||||
| 1 | 2,5 | 0,023 | 99,1 | 0,0413 |
| 2 | 5,0 | 0,045 | 99,1 | 0,0826 |
| 3 | 7,5 | 0,062 | 99,1 | 0,1239 |
| рН=10 | ||||
| 1 | 2,5 | 0,031 | 98,8 | 0,0412 |
| 2 | 5,0 | 0,053 | 98,9 | 0,08245 |
| 3 | 7,5 | 0,077 | 98,9 | 0,1237 |
Степень очистки во всех изученных систем составляет 99 %. Рассчитана величина адсорбции хромат-ионов на анионите, получено, что адсорбция увеличивается с увеличением концентрации. Показано, что ионный обмен при различных значениях рН исходного раствора, практически не влияет на степень очистки.
Применяя для регенерации анионита 10 % раствор гидроксида натрия в течение часа, позволяет практически полностью восстановить ионообменную смолу.
Вывод
Предложенный способ очистки растворов отходов химических реактивов на анионите АВ-17 позволяет практически полностью очистить сливы водный растворов химических реактивов, позволяет снизить экологическую нагрузку на канализационные воды.
Библиографический список
- Филов В.А. “Вредные химические вещества”. “Неорганические соединения элементов V-VIII групп” – М.: Химия, 1998 – 600 с.
- Крамаренко В.Ф. “Токсикологическая химия”, М.: Высш. шк., 1996 – 350 с.
- Чикин Г.А., Мягков О.Н., “Ионообменные методы очистки веществ”. Учебное пособие Воронеж: изд-во ВГУ, 1984 – 372 с.
- Ветошкин А.Г., Таранцева К.Р. Технология защиты окружающей среды (теоретические основы). Учебное пособие Пенза: Изд-во Пенз. технол. ин-та, 2004 – с.
- Рябчиков Б.Е. Современные методы подготовки воды для промышленного и бытового использования. –М.: ДеЛи принт, 2004. –328 с. ISBN: 5-94343-079-2.
- Кельцев Н.В. Основы адсорбционной техники. 2-е изд. – М.: Химия, 1984.- 372 с.
