Введение
В настоящее время в числе основных и опасных загрязнителей объектов окружающей среды, в частности водной среды, в крупных индустриальных центрах все чаще рассматривают химические элементы с атомной массой более 50 и их соединения – это соли (или ионы) тяжелых металлов. Эти соединения образуют значительную группу токсикантов, которые определяют антропогенное воздействие на экологическую структуру окружающей среды и на человека. Это связано со все возрастающим масштабами производства и применения тяжелых металлов, их высокой токсичностью, способностью накапливаться в организме человека, оказывать вредное влияние даже в сравнительно небольших концентрациях.
Опасность загрязнения среды тяжелыми металлами объясняется тем, что они вечны, ибо в отличие от органических загрязнителей, они не разрушаются, а лишь переходят из одной формы существования в другую, в частности, включаются в состав солей, оксидов, металлоорганических соединений, хелатов и др. [1, 2].
В последние годы остро стоит проблема очистки воды от ионов тяжелых металлов. Одним из наиболее распространенных методов очистки является сорбционный. В большинстве случаев наилучших результатов достигают, применяя синтетические сорбенты, например, ионообменные смолы – иониты, которым свойственны высокие сорбционные свойства и возможность повторного использования. Однако основным недостатком данных сорбентов является достаточно высокая стоимость, обусловленная многостадийностью процессов их получения. Кроме того, при их промышленном синтезе в качестве исходных соединений используют токсичные вещества (бензол, фенолы и др.), а источником ионообменных сорбентов является невозобновляемое органическое сырье [3].
Сейчас большой интерес представляет разработка сорбентов на основе многотоннажных побочных продуктов или отходов сельского хозяйства, целлюлозно-бумажной и текстильной промышленности. Эти материалы имеют более низкую стоимость, доступны и просты по способам утилизации, обладают достаточно высокими сорбционными характеристиками по широкой гамме металлов-загрязнителей и являются экологически чистыми [4, 5, 6].
Из природных органических волокон наиболее важным в практическом отношении является шерсть различных животных (овец, коз, верблюдов, ламы и др.). Шерсть этих животных отличается по своему качеству в зависимости от происхождения, но и имеет и много общего и, прежде всего непревзойденные теплоизоляционные, упруго-эластические свойства. Причиной таких исключительно ценных качеств является, прежде всего, ее природные функции у животных. Эти свойства реализуются через основное белковое вещество шерсти – кератин [7].
Гидрофобность кератина определяется содержанием в ним кислот: аланина, фенилаланина, валина, лейцина, изолейцина, т. е. аминокислот не содержащих полярные группировки. Эти гидрофобные кислоты определяют и некоторые трудности при смачивании шерсти.
Напротив гидрофильность кератина шерсти обусловлена наличием оксиаминокислот: серина, треонина, тирозина. Кислотные свойства кератина охарактеризованы наличием в нем дикарбоновых кислот: аспарагиновой и глутаминовой. Кислотные свойства кератина преобладают, как и у большинства белков, над основными не только потому, что в кератине несколько больше кислотных групп, а потому, что степень ионизации (рКсоон) карбоксильных групп большинства α– аминокислот больше степени протонирования аминогрупп (рКNH2). Эта избыточная кислотная ионизация компенсируется добавкой кислоты. Поэтому изоэлектрическая точка шерсти 3,4.
Содержание серы в шерсти обусловлено наличием метионина и цистина. Последний в основном и определяет содержание серы в кератине. Эта кислота, содержащая дисульфидную связь, соединяет, как правило, две соседние пептидные цепи ковалентной дисульфидной связью, поэтому кератин является редкосшитым (сетчатым, трехмерным) биополимером. Кератин один из немногих белков, содержащих цистин в большом количестве [8].
Наличие поперечных ковалентных связей делает кератин нерастворимым в воде и других полярных растворителях, обеспечивает, наряду с другими элементами (наличие α– спирали, извитость волокна и др.), структуры формоустойчивости шерсти.
Большое содержание дикарбоновых и диаминокислот по сравнению с другими белками (фиброин, серицин) определяет более рыхлую упаковку макромлекул (объемные боковые радикалы) в третичной и четвертичной радикалах [8].
Таким образом, выбор шерстяного волокна в качестве сорбента позволяет одновременно решить две задачи: очистку воды и утилизацию отходов текстильной промышленности [13].
Целью данной работы является разработка сорбента с улучшенными сорбционными свойствами для очистки водных растворов от ионов тяжелых металлов путем химического модифицирования шерстяного волокна, а также установление закономерностей протекания процесса сорбции с участием данного сорбента.
Экспериментальная часть.
Перед процессом модификации шерсть подвергают предварительной обработке путем промывки. Образец шерстяного волокна промывают в 50 мл раствора, содержащего 5 г/л ПАВ (мыло), 0,4 г/л соды кальцинированной. Обработку проводят при 35-40°С в течение 20 минут. Затем шерсть промывают теплой водой и высушивают [9].
С целью улучшения сорбционных свойств шерстяного волокна проводят модифицирование кератина шерсти с помощью синтеза привитых сополимеров [10]. Способ основан на реакции свободнорадикальной полимеризации. В результате реакции образуется сополимер, у которого основная цепь макромолекулы состоит из полипептидной цепи, к звеньям которого привиты боковые цепи, состоящие из структурных единиц другого полимера: для образования цепочек полимера используют винильные мономеры (CH2 = CHR) в виде метакриловой кислоты.
Механизм модифицирования шерстяного волокна метакриловой кислотой проходит в две стадии:
На первой стадии шерстяное волокно обрабатывают при модуле М = 50 водным раствором соли Мора (при 20 °С и рН 5-5,5 в течение 1,5-2 ч). При снижении рН замедляется сорбция железа волокном, а при повышении — ускоряется процесс окисления железа кислородом воздуха.
На второй стадии протекает реакция привитой сополимеризации. Для этого волокно обрабатывают в ванне, содержащей 10 г/л метакриловой кислоты и 0,2 г/л 30 % Н2О2 в течение 30 мин при 70°С и М = 50.
Кинетику сорбции ионов Cu2+ исследуют в статических условиях методом ограниченного объема раствора [8]. Для получения кинетических кривых в серию пробирок помещают навески сорбента массой по 0,10 г, заливают их 10 мл водного раствора сульфата меди. Начальная концентрация ионов Cu2+составляла 1,5·10-4 моль/л и выдерживают от 15 минут до 24ч. Через определенные промежутки времени раствор отделяют от сорбента фильтрованием и определяют в нем текущую концентрацию ионов металлов (Сτ) методом атомно-абсорбционной спектроскопии на приборе 210VGP
Сорбционную емкость сорбента в каждый конкретный момент времени τ рассчитывают по формуле (1):
где Сsorb.– сорбционная емкость, ммоль/г; С0 – начальная концентрация ионов металла, моль/л; С – концентрация ионов металла в момент времени , моль/л; m – масса навески сорбента, г; V – объем раствора, л.
Для исследования влияния концентрации металла в растворе на равновесие в ионообменной системе снимают изотермы сорбции. Для получения изотерм процесс сорбции проводят следующим образом: в серию пробирок помещают навески сорбента массой по 0,10 г и заливают их 10 мл водного раствора сульфата меди с концентрациями Cu2+ в интервале 1,510-4 – 510-2 моль/л и выдерживают при перемешивании до установления состояния равновесия (время достижения сорбционного равновесия определяют при исследовании кинетики сорбции). Затем раствор отделяют от сорбента фильтрованием и определяют в нем равновесную концентрацию ионов металла (Се) методом атомно-абсорбционной спектроскопии. В условиях установившегося равновесия в системе определяют равновесную концентрацию ионов меди в растворе (Се) и рассчитывают равновесную сорбционную емкость:
где Сsorb.,e – равновесная сорбционная емкость, мг/г; Се – равновесная концентрация ионов металла, моль/л.
Степень извлечения α определяют следующим образом:
.gif) (3)
(3)Коэффициент распределения KD рассчитывают как отношение концентрации ионов металла в фазе полимера (Сsorb.) к его содержанию в растворе:
Результаты и их обсуждение.
Для определения равновесно-кинетических характеристик образцов сорбента были получены кинетические кривые сорбции ионов Cu(II) из водного раствора CuSO4. Результаты эксперимента представлены на рисунке 1.
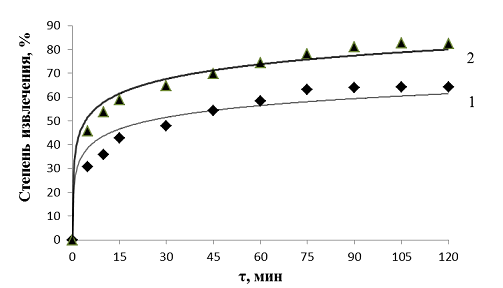
1 – шерсть (исходный образец); 2 – шерсть, (модификация метакриловой кислотой)
Рисунок 1 – Сравнение кинетических характеристик исходного (1) и модифицированного (2) шерстяного волокна
Согласно полученным данным шерстяное волокно сравнительно эффективно сорбирует ионы меди. Сорбционные свойства модифицированного шерстяного волокна по отношению к ионам Cu (II) возрастают при использовании модифицирующего агента.
Кинетические исследования показали, что время достижения сорбционного равновесия в гетерогенной системе водный раствор сульфата металла – сорбент составляет 75 минут. При этом степень извлечения ионов тяжелых металлов для исследуемых сорбентов увеличилось в 1,3 раза по сравнению с исходным образцом.
Для определения максимальной сорбционной емкости (А) образцов шерстяного волокна (исходного и обработанного метакриловой кислотой) были получены изотермы сорбции ионов Cu(II) из водного раствора при 293 К (рисунок 2).
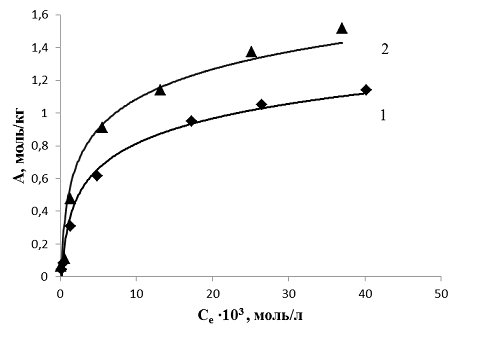
1 – шерсть (исходный образец); 2 – шерсть, (модификация метакриловой кислотой)
Рисунок 2 – Изотермы сорбции ионов меди образцами исходного (1)
и модифицированного (2) шерстяного волокна
Полученные экспериментальные данные описаны уравнением изотермы адсорбции Ленгмюра:

где АR – предельная или максимальная сорбционная емкость полимера по данному металлу, моль/кг; К – концентрационная константа сорбционного равновесия, характеризующая интенсивность процесса сорбции, л/моль; Се – равновесная концентрация сорбата, моль/л [9].
Линеаризация изотермы сорбции по уравнению (5) позволяет графически определить в уравнении Ленгмюра величины А и К из опытных данных по распределению исследуемого сорбата в гетерофазной системе водный раствор – сорбент шерстяное волокно.
.gif)
Результаты обработки изотермы сорбции ионов меди шерстяным волокном по модели Ленгмюра представлены на рисунке 3 и в таблице 1.
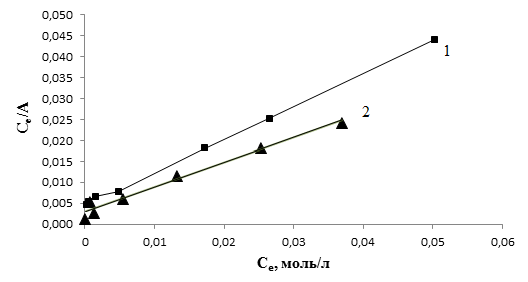
Таблица 1 – Параметры обработки изотерм сорбции ионов Cu(II) по модели Ленгмюра методом наименьших квадратов
|
Наименование образца
|
Катион
металла |
1/АК
|
1/А
|
Коэффициент корреляции
|
А, моль/кг
|
|
Шерсть (исходный образец)
|
Cu(II)
|
0,005±510-4
|
0,78±0,07
|
0,99
|
1,3
|
|
Шерсть(обработка метакриловой кислотой) |
Cu(II)
|
0,003±310-4
|
0,6± 0,06
|
0,99
|
1,7
|
Таким образом, как видно из рис. 3 в координатах Се/А – Се наблюдается линейная зависимость с коэффициентами корреляции (R) 0,99. Это говорит о том, что экспериментальные данные по сорбции ионов меди на волокнах шерсти хорошо аппроксимируются уравнением Ленгмюра, а из значений величин предельной сорбции (А∞) (табл. 1,), полученных в ходе обработки изотерм сорбции с использованием этого уравнения, следует, что данный сорбент обладает сравнительно высокой связывающей способностью по отношению к ионам меди.
Выводы. Исследованы сорбционные свойства кератина шерсти по отношению к ионам Cu2+. Определены равновесно-кинетические характеристики сорбента: время достижения сорбционного равновесия составляет 75 мин.
Экспериментальные данные по сорбции ионов меди на шерстяном волокне хорошо аппроксимируются уравнением Ленгмюра. и в ходе обработки изотерм сорбции, следует, что данный сорбент обладает сравнительно высокой связывающей способностью по отношению к ионам меди.
Время достижения сорбционного равновесия при использовании модифицированного сорбента не изменяется и составляет 75 минут, а величина предельной сорбции увеличивается в 1,3 раза по сравнению с исходным образцом.
Библиографический список
- Кораблева А. Н. Введение в экологическую токсикологию / А. Н. Кораблева, Л. Г. Чесанов, А. Г. Шапарь. – Д.. Центр экономического образования, 2001. – 308 с.
- Витол И.С., Коваленок А.В., Нечаев А.П. Безопасность продовольственного сырья и продуктов питания. Учебник. М.: ДеЛи принт, 2013. 352 с.
- Николайкин Н. И., Николайкина Н. Е., Мелихова О. П. Экология: учебник для вузов. 3-е изд. М.: Дрофа, 2004. 624 с.
- Никифорова, Т.Е., Козлов В.А., Родионова М.В. Сорбция ионов меди модифицированным белково-целлюлозным комплексом барды // Химия растительного сырья. – 2008. – №4. – С. 41-46.
- Никифорова, Т.Е., Козлов В.А., Багровская Н.А., Натареев С.В. Сорбционные свойства льняного волокна, модифицированного плазмой / Т.Е. Никифорова, В.А. Козлов, Н.А. Багровская, С.В. Натареев // Журнал Прикладной Химии. – 2008. – Т. 81, Вып. 7. – С. 1096-1100.
- Никифорова, Т.Е. Сорбция ионов Cu(II) соевым шротом, модифицированным монохлорацетатом натрия / Т.Е. Никифорова, В.А. Козлов // Журн. Прикл. Химии. – 2008. – Т. 81, Вып. 2. – С. 428-433.
- Александер, П.В. Физика и химия шерсти. Пер с англ. / П. В. Александер, Р. Ф. Хадсон.- М.: Химия, 1958. – 288 с.
- Кричевский, Г.Е. Химическая технология текстильных материалов: Учеб. для вузов в 3-х т., Т.1. М., 2000.436с.
- Модификация кератина шерсти. [Электронный ресурс] URL: http://pavelpp.ru/644.html // (Дата обращения 4.09.16).
- Присутствие макрофитов в водной системе ускоряет снижение концентраций меди, свинца и других тяжелых металлов в воде. // Водное хозяйство России. 2009. N. 2.
- Фролов Ю. Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы; 2-е изд., перераб. и доп. М.: Химия, 1989. 464 с.
- Никифорова, Т.Е. Особенности сорбции ионов тяжелых металлов белковым сорбентом из водных сред / Т.Е. Никифорова, В.А. Козлов, М.В. Родионова // Журн. Прикл. Химии. – 2010. – Т. 83, Вып. 7. – С.1073-1078.
- Гарцева, Л.А. Лабораторный практикум по химической технологии текстильных материалов: учеб. пособие/ Л.А. Гарцева. – Иваново:ИГТА, 2011. – 136с.
