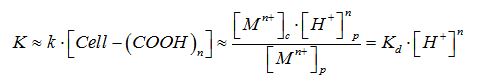Введение
В настоящее время большое внимание уделяется исследованиям, использующим побочные продукты сельского хозяйства в качестве эффективных сорбентов для извлечения ионов тяжелых металлов из водных сред различной природы. Основными преимуществами сырья на основе продуктов переработки сельскохозяйственных культур являются: доступность, низкая стоимость, быстрая возобновляемость источников и простота утилизации отработанного сорбента.
Интерес в настоящее время проявляется к исследованию сорбционных свойств таких продуктов растительного происхождения, как пшеничные отруби, древесные опилки, кора деревьев, льняное волокно, целлюлоза, способных эффективно сорбировать ионы тяжелых металлов [1,2].
Целью настоящей работы явилось установление закономерностей распределения ионов Cu(II) в гетерофазной системе водный раствор соли металла – целлюлозный сорбент, влияние рН среды на сорбцию Cu(II) из водных растворов.
Экспериментальная часть
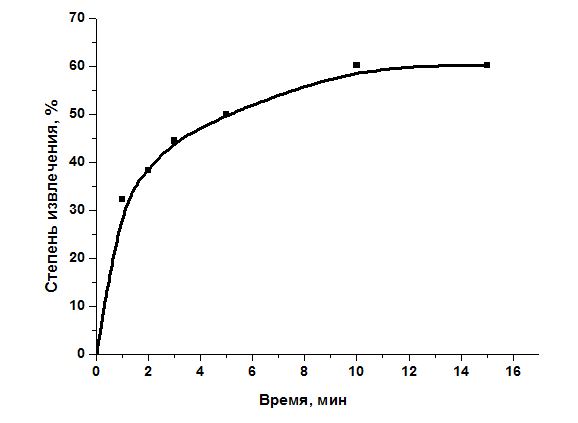
В процессе сорбции важную роль играют равновесно-кинетические характеристики. В результате кинетического эксперимента в статических условиях при перемешивании установлено, что процесс сорбции хлопковой целлюлозой происходит в течение 10 мин. Результаты эксперимента представлены на рисунке 1.
Рисунок 1. Кинетическая кривая сорбции ионов Cu(II) из водных растворов хлопковой целлюлозой
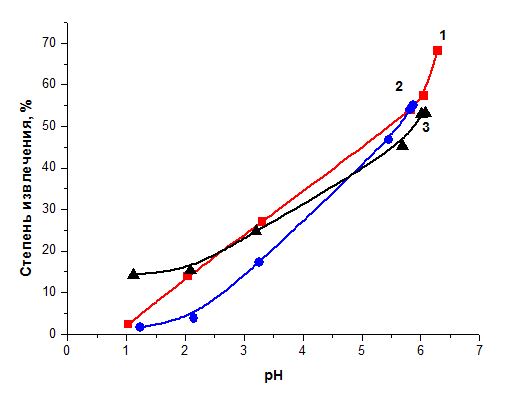
Изучение влияния водородного показателя раствора на процесс сорбции ионов тяжелого металла проводили при помощи рН-метра Эксперт-рН. Необходимую величину кислотности среды создавали, используя азотную, соляную и хлорную кислоты. Остаточную концентрацию ионов металла в растворе определяли на атомно-абсорбционном спектрофотометре 210VGP [3].
Результаты опыта представлены на рисунке 2.
1 – азотная кислота; 2 – соляная кислота; 3 – хлорная кислота.
Рисунок 2. Влияние рН водного раствора на сорбцию ионов Cu(II)
Максимальное извлечение ионов Cu(II) хлопковой целлюлозой наблюдается при рН 5,5-6,0.
Сорбционные равновесия характеризуются коэффициентом распределения Кd, представляющим собой отношение общей концентрации вещества в фазе сорбента к его общей концентрации в растворе:
Kd = [Mn+]с / [Mn+]р (1)
Сорбцию ионов металлов за счет ионного обмена с участием карбоксильных групп сорбента можно представить следующим образом (Cell-COOH, где Cell – сорбент):
Cell-[(-СOOH)2(Н2О)n]+(М2+)р ↔ (2Н+)р+ Cell-[-O2 М (Н2О)n] (2)
Экспериментальные данные были представлены в координатах уравнения:
или в линейной логарифмической форме [4]:
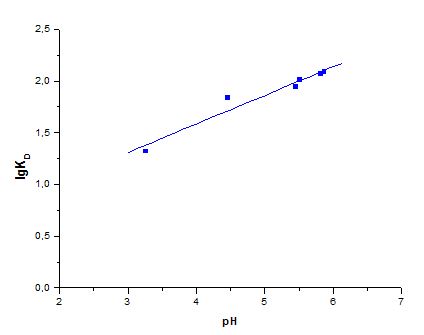
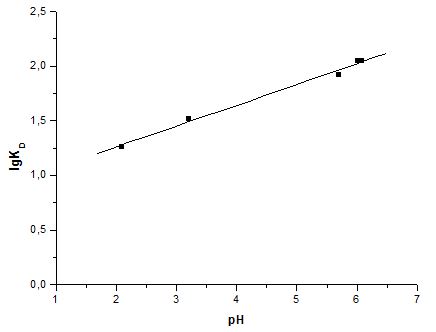
Результаты обработки полученных данных методом наименьших квадратов представлены на рисунках 3,4,5 и в таблице 1.
Таблица 1 – Параметры уравнения
|
Кислота |
const |
n |
Коэффициент корреляции |
|
Азотная |
0,67±0,11 |
0,25±0,02 |
0,99 |
|
Соляная |
0,48±0,17 |
0,28±0,03 |
0,97 |
|
Хлорная |
0,87±0,05 |
0,19±0,01 |
0,99 |
Рисунок 3. Влияние рН водного раствора на распределение ионов Cu(II) в системе (Ме(NO3)2 – H2O – HNO3) – сорбент
Рисунок 4. Влияние рН водного раствора на распределение ионов Cu(II) в системе (МеCl2 – H2O – HCl) – сорбент
Рисунок 5. Влияние рН водного раствора на распределение ионов Cu(II) в системе (МеCl2 – H2O – HClO4) – сорбент
Выводы
В данной работе исследованы сорбционные свойства хлопковой целлюлозы по отношению к ионам Cu(II). Среднее время достижения сорбционного равновесия в гетерофазной системе водный раствор соли металла – сорбент составляет 10 минут. Установлено, что максимальное извлечение ионов Cu(II) сорбентом наблюдается при рН 5,5-6,0. Таблица 1 показывает, что тангенс угла наклона линейной зависимости lgKD – рН для иона Cu(II) намного меньше единицы и составляет ≈ ¼. Это объясняется эквивалентным участием протонов и анионов водной фазы в молекулярной форме кислотного компонента при межфазном обмене d-металлов и протонов [5].
Библиографический список
- Макаренок Н.В., Ярусова С.Б., Азарова Ю.А., Земнухова Л.А. Кинетика сорбции ионов тяжелых металлов сорбентом из отходов производства риса // Вестник ДВО РАН. 2015. № 4. С. 94-99.
- Никифорова Т.Е., Козлов В.А., Модина Е.А. Сольватационно-кординационный механизм сорбции ионов тяжелых металлов целлюлозосодержащим сорбентом из водных сред // Химия растительного сырья. 2010. № 4. С. 23-30.
- Ахназарова С. Л., Кафаров В.В. Методы оптимизации эксперимента в химической технологии. М.: Высшая школа, 1985. 327 с.
- Никифорова Т.Е., Козлов В.А., Модина Е.А. Сольватационно-кординационный механизм сорбции ионов тяжелых металлов целлюлозосодержащим сорбентом из водных сред // Химия растительного сырья. 2010. № 4. С. 23-30.
- Никифорова Т.Е., Козлов В.А., Родионова М.В., Модина Е.А. СОРБЦИЯ ИОНОВ ЦИНКА ПРОДУКТАМИ, СОДЕРЖАЩИМИ ЦЕЛЛЮЛОЗНУЮ И БЕЛКОВУЮ СОСТАВЛЯЮЩИЕ // Известия высших учебных заведений. Серия: Химия и химическая технология. 2009. Т. 52. № 3. С. 27-31.