Введение. Развитие нанотехнологий позволило получать материалы, обладающие уникальными свойствами и идеально подходящими на роль упаковочных материалов, способных значительно увеличить сроки хранения пищевых продуктов [1, 2]. Интерес к наночастицам серебра и материалам с их использованием растет лавинообразно в основном из-за их необычных физических характеристик, отличных от свойств соответствующих компактных материалов [3 - 6]. Важными свойствами серебра являются бактерицидная и антивирусная активности. Они существенно возрастают при использовании наночастиц вследствие резкого увеличения площади поверхности. Поэтому наночастицы серебра могут быть использованы для придания упаковочным материалам биоцидных свойств.
Таким образом, целью работы является внедрение наночастиц серебра в целлюлозную матрицу, которая может быть использована при изготовлении упаковок, предназначенных для продления сроков хранения пищевых продуктов.
Экспериментальная часть. Наночастицы серебра получали путем восстановления водного раствора нитрата серебра (квалификация «хч»). В качестве восстановителя использовали глюкозу (квалификация «хч»). Все растворы готовили на дистиллированной воде. Золь готовили смешением растворов нитрата серебра с глюкозой в соотношении объемов 1:1. Обработку смеси проводили раствором гидроксида аммония (10 %, квалификация «хч»), так как размеры наночастиц серебра зависят от рН среды [7]. Затем золь нагревали в течение 1,5 часов при температуре 70 °С.
Полученные наночастицы изучались методом атомно-силовой микроскопии (АСМ) полуконтактным методом с помощью сканирующего зондового микроскопа Solver P47 PRO на воздухе при комнатной температуре. Зондом служил кремниевый кантилевер с типичной резонансной частотой около 150 кГц. Для наблюдения наночастиц серебра каплю полученного золя наносили на поверхность чистого стекла размером 20 × 10 мм, давали ей высохнуть при комнатной температуре.
В работе использовались следующие методы закрепления наночастиц серебра/оксида серебра на поверхности полимеров и пленок:
1) метод, основанный на синтезе наночастиц оксида серебра с их одновременным закреплением в порах и на поверхности полимера;
2) метод, основанный на синтезе наночастиц серебра с их одновременным закреплением в порах и на поверхности полимера/пленки;
3) метод нанесения раствора наночастиц серебра на полимер/пленку с использованием ультразвука.
Метод, основанный на синтезе наночастиц оксида серебра с их одновременным закреплением в порах и на поверхности полимера. В пробирки, заполненные растворами нитрата серебра различных концентраций (0,00005 моль/л; 0,0001 моль/л; 0,0005 моль/л; 0,001 моль/л; 0,005 моль/л), помещаются образцы целлюлозы. После этого растворы нагреваются при температуре 70 °С в течение 1,5 часов. При этом происходят синтез наночастиц оксида серебра и их одновременное первичное закрепление в порах и на поверхности целлюлозы. Далее образцы промываются дистиллированной водой, с целью удаления слабо закрепленных наночастиц, и высушивают током горячего воздуха в течение 2 часов при температуре 160 °С.
Метод, основанный на синтезе наночастиц серебра с их одновременным закреплением в порах и на поверхности полимера/пленки. В пробирки, заполненные растворами нитрата серебра и глюкозы (концентрация нитрата серебра 0,0005 моль/л, концентрация глюкозы 0,05 моль/л, значение рН 8,5), помещаются образцы целлюлозы и целлофана. После этого растворы нагреваются при температуре 70 °С в течение 1,5 часов. При этом происходят синтез наночастиц серебра и их одновременное первичное закрепление в порах и на поверхности целлюлозы и целлофана. Далее образцы промываются дистиллированной водой и высушиваются током горячего воздуха в течение 2 часов при температуре 160 °С.
Метод нанесения наночастиц серебра на полимер/пленку с использованием ультразвука. Образцы целлюлозы и целлофана помещаются в пробирки с свежеприготовленным раствором наночастиц серебра (концентрация нитрата серебра 0,0005 моль/л, концентрация глюкозы 0,05 моль/л, значение рН 8,5, температура 70 °С, время нагревания 1,5 ч), установленные в емкость ультразвукового диспергатора УЗДН-2т, который снабжен ультразвуковым излучателем с частотой звукового излучения 44 кГц. После этого включается генератор ультразвука, и пробирки с образцами находятся в емкости диспергатора определенное время (1 мин, 10 мин, 20 мин, 30 мин). При этом происходит первичное закрепление наночастиц серебра на поверхности целлюлозы и целлофана. Далее образцы промываются дистиллированной водой и высушиваются током горячего воздуха в течение 2 часов при температуре 160 °С.
Процедура определения острой токсичности водной вытяжки, содержащей наночастицы серебра/оксида серебра, методом биотестирования по смертности дафний [8]. Биотестирование проводится в химических стаканах, которые заполняются либо 100 см3 исследуемой водной вытяжки, либо 100 см3 разбавленной исследуемой водной вытяжки. В стаканы помещают по десять дафний в возрасте 6 – 24 часа. Учет смертности дафний в опыте проводят через 24 часа.
Процедура определения острой токсичности водной вытяжки, содержащей наночастицы серебра/оксида серебра, методом биотестирования по изменению оптической плотности культуры водоросли хлорелла [9]. Для биотестирования используют чистую культуру водорослей Chlorella vulgaris Beijer, находящуюся в экспоненциальной стадии роста. Для приготовления водных вытяжек используется дистиллированная вода. Приготовленная тест-культура водоросли вносится по 2 см3 в химические стаканы с 48 см3 контрольной и тестируемых проб водных вытяжек. Также во все стаканы вносятся по 0,4 см3 заранее приготовленных растворов микроэлементов. По окончании 6 см3 содержимого каждого стакана вносится во флакон-реактор. После этого флаконы с пробками устанавливаются в культиватор КВМ-05, где определяются ростовые характеристики культуры водоросли хлорелла. Через 22 часа культивирования проводится измерение оптической плотности суспензии водоросли во всех флаконах измерителем ИПС-03.
Результаты и их обсуждение. Важным условием применимости наночастиц серебра/оксида серебра для изготовления упаковочных материалов является их способность к закреплению на поверхности и в порах материала для упаковки. Данное условие может быть обеспечено использованием различных вариантов полимерной основы, а также различных технологий нанесения наночастиц на поверхность полимера.
В целом, методы, используемые в данной работе, состоят из двух основных этапов: первоначального нанесения наночастиц либо одновременного синтеза и нанесения наночастиц; их закрепления на поверхности полимеров и пленок. Помимо этапа нанесения наночастиц серебра/оксида серебра, важным является этап закрепления. Закрепление наночастиц может происходить еще на этапе нанесения. Прочность такого закрепления зависит от свойств наночастиц и метода нанесения. Прочное закрепление осуществляется при наличии физической связи между наночастицами и поверхностью полимера/пленки (в результате возникновения сил межмолекулярного притяжения). Основной задачей второго этапа – дополнительного закрепления наночастиц – является снижение их миграции в продукт в определенных пределах. Дополнительное закрепление осуществляется нагреванием материала с наночастицами серебра/оксида серебра. Нагрев материала с нанесенными на него наночастицами приводит к вплавлению нанокомпонента в структуру полимера/пленки. Данный метод прост, однако его применение может привести к изменению формы изделия и его свойств.
Оценка результатов синтеза наночастиц оксида серебра с их одновременным закреплением в порах и на поверхности полимера. В результате визуальной оценки полученных полимеров (целлюлозы) по данному методу было обнаружено, что их окраска изменяется от светло-желтой до бурой (исходная целлюлоза имела белый цвет), то есть полученные композиты окрашиваются в цвет раствора, который использовался при их изготовлении. Следовательно, прошли синтез наночастиц оксида серебра и закрепление их в порах и на поверхности целлюлозы.
По методу, основанному на синтезе наночастиц серебра с их одновременным закреплением в порах и на поверхности полимера/пленки, было обнаружено, что полученные полимеры и пленки имеют желтую окраску (в отличие от окрасок исходных материалов), то есть окрашивание произошло успешно. Следовательно, прошли синтез наночастиц серебра и закрепление их в порах и на поверхности целлюлозы и целлофана.
По методу нанесения раствора наночастиц серебра на полимер/пленку с использованием ультразвука, было обнаружено, что полученные полимеры имеют желтоватую окраску, то есть они окрашиваются в цвет раствора, который использовался при их изготовлении. В результате визуальной оценки полученных пленок (целлофана), было обнаружено, что окраска пленок (целлофана) изменяется от светло-желтого до желтого. Это указывает на то, что произошло расплавление целлюлозы и целлофана в местах нахождения наночастиц, а также прошло их закрепление.
Таким образом, все три метода являются эффективными при изготовлении упаковки с антимикробными свойствами. Полученные данными методами материалы могут использоваться при изготовлении упаковки различных как пищевых, так и непищевых продуктов и изделий, где актуальным является поддержание асептических условий продолжительное время.
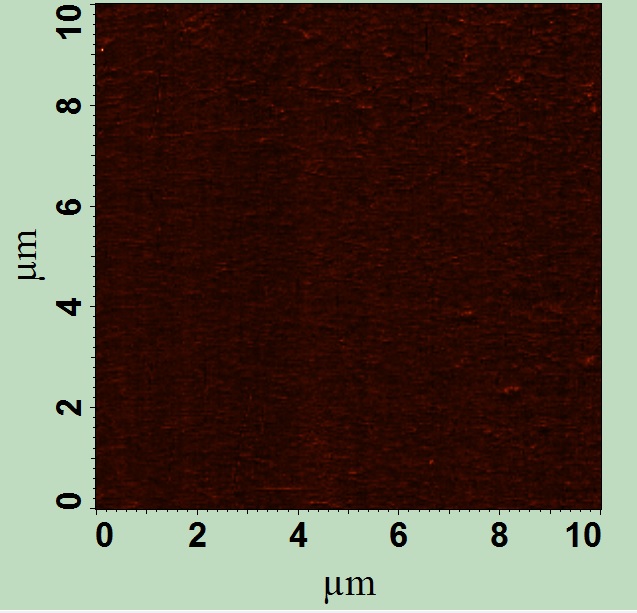
Определение наночастиц на целлофане, пригодных для изготовления упаковок, производилось методом атомно-силовой микроскопии. Предварительная пробоподготовка образцов не производилась. Исследование образцов проходило в режиме фазового контраста. Данный режим позволяет селективно обнаруживать определенные виды наночастиц на поверхности полимера. Средний размер не должен сильно отклоняться от размера исходных наночастиц в растворе и не должен превышать 100 нм (рисунок 1).
а в
Рисунок 1 – Изображения фазового контраста исходного целлофана (а) и целлофана с наночастицами серебра, полученного с помощью ультразвука, время обработки 30 минут (в), полученных с помощью полуконтактной АСМ
Как видно из рисунка 1, поверхность целлофана содержит искомые наночастицы серебра сферической формы и размером до 100 нм. Более крупные образования являются результатом агрегации наночастиц. Поскольку метод АСМ не позволяет проводить качественный анализ материалов, то говорить о том, имеются ли наночастицы в порах целлофана, нельзя. Но следует отметить, что в структуре целлофана после обработки ультразвуком появляются некоторые разрушения, которые вероятно всего связаны с его воздействием. Поэтому некоторое количество наночастиц прошло в поры целлофана и закрепилось в них. Необходимо отметить, что поверхность целлофана не является абсолютно гладкой и имеет собственный рельеф, что может привести к некорректным результатам.
Определение наночастиц оксида серебра на целлюлозе, пригодных для изготовления упаковок, производилось методом сканирующей электронной микроскопии на микроскопе JEOL серии JSM-6510. Предварительная пробоподготовка образцов не производилась (рисунок 2).


Как видно из рисунка 2, поверхность целлюлозы содержит искомые наночастицы оксида серебра сферической формы.
В данной работе были получены материалы, содержащие наночастицы серебра/оксида серебра и служащие основой для создания упаковки, продлевающей сроки хранения пищевых продуктов. Для достижения этой цели необходимо, чтобы нанокомпонент (в данном случае серебро/оксид серебра) мог взаимодействовать с продуктом, точнее с микроорганизмами, находящимися на поверхности или в основной массе продукта. Для того чтобы это взаимодействие осуществилось, необходима миграция наночастиц из пленки/полимера в продукт, однако она должна быть такой, чтобы не происходило избыточного загрязнения продукта, а концентрация наночастиц серебра, перешедших в продукт, не была токсичной для человека. С этой целью был проведен токсикологический метод анализа водных вытяжек, который контактировал с материалами, содержащими наночастицы серебра/оксида серебра.
Оценка результатов острой токсичности водной вытяжки, содержащей наночастицы серебра/оксида серебра, методом биотестирования по смертности дафний (таблица 1 – 3). Водная вытяжка, полученная при контакте культивационной воды с целлюлозой, содержащей наночастицы оксида серебра (при концентрации нитрата серебраравной 0,005 моль/л), а также водная вытяжка, полученная при контакте культивационной воды с полимером (целлюлозой), при синтезе наночастиц серебра с их одновременным закреплением в порах полимера, являются остро токсичными, поскольку смертность дафний в данных водных вытяжках равна 100 %. Данная миграция наночастиц серебра/оксида серебра связана с ненадежным закреплением их в порах поверхностного слоя полимера. Следовательно, такие материалы нельзя использовать для изготовления упаковок, так как при хранении в них пищевых продуктов наночастицы серебра/оксида серебра будут мигрировать в продукт в количествах, опасных для человека.
Во всех остальных исследуемых образцах метод биотестирования свидетельствует о выживании всех дафний в эксперименте. Таким образом, полученные материалы, содержащие наночастицы серебра/оксида серебра, являются безопасными для человека и могут быть использованы для изготовления упаковок для пищевых продуктов. Однако в водных вытяжках после контакта культивационной воды с полимерами/пленками, полученными при нанесении наночастиц серебра ультразвуком, не было зарегистрировано ни одной смерти дафнии. Поэтому данный метод нанесения наночастиц на полимер/пленку является самым безопасным по сравнению с другими методами.
Таблица 1 – Результаты измерения острой токсичности водной вытяжки после контакта культивационной воды с целлюлозой, содержащей наночастицы оксида серебра
|
Концентрация AgNO3, моль/л |
Полимер с наночастицами оксида серебра (Ag2O) |
Процентное содержание исследуемой водной вытяжки при разбавлении, % |
Время от начала биотести-рования, ч |
Количество выживших дафний |
Смерт-ность дафний в опыте, % |
|
|
в контроле |
в опыте |
|||||
|
0,00005 |
Целлюлоза |
100 |
24 |
10 |
10 |
0 |
|
0,005 |
Целлюлоза |
100 |
24 |
10 |
0 |
100 |
Таблица 2 – Результаты измерения острой токсичности водной вытяжки после контакта культивационной воды с полимером/пленкой, полученными при синтезе наночастиц серебра с их одновременным закреплением в порах полимера/пленки
|
Полимер/пленка с наночастицами серебра |
Процентное содержание исследуемой водной вытяжки при разбавлении, % |
Время от начала биотестирования, ч |
Количество выживших дафний |
Смерт-ность дафний в опыте, % |
|
|
в контроле |
в опыте |
||||
|
Целлофан |
1 |
24 |
10 |
10 |
0 |
|
Целлофан |
10 |
24 |
10 |
10 |
0 |
|
Целлофан |
100 |
24 |
10 |
10 |
0 |
|
Целлюлоза |
100 |
24 |
10 |
0 |
100 |
Таблица 3 – Результаты измерения острой токсичности водной вытяжки после контакта культивационной воды с полимером/пленкой, полученными при нанесении наночастиц серебра ультразвуком
|
Время обработки ультра-звуком, мин |
Полимер/пленка с наночастицами серебра |
Процентное содержание исследуемой водной вытяжки при разбавлении, % |
Время от начала биотести-рования, ч |
Количество выживших дафний |
Смертность дафний в опыте, % |
|
|
в контроле |
в опыте |
|||||
|
10 |
Целлофан |
1 |
24 |
10 |
10 |
0 |
|
10 |
Целлофан |
10 |
24 |
10 |
10 |
0 |
|
10 |
Целлофан |
100 |
24 |
10 |
10 |
0 |
|
10 |
Целлюлоза |
1 |
24 |
10 |
10 |
0 |
|
10 |
Целлюлоза |
10 |
24 |
10 |
10 |
0 |
|
10 |
Целлюлоза |
100 |
24 |
10 |
10 |
0 |
|
30 |
Целлофан |
1 |
24 |
10 |
10 |
0 |
|
30 |
Целлофан |
10 |
24 |
10 |
10 |
0 |
|
30 |
Целлофан |
100 |
24 |
10 |
10 |
0 |
|
30 |
Целлюлоза |
1 |
24 |
10 |
10 |
0 |
|
30 |
Целлюлоза |
10 |
24 |
10 |
10 |
0 |
|
30 |
Целлюлоза |
100 |
24 |
10 |
10 |
0 |
Оценка результатов острой токсичности водной вытяжки, содержащей наночастицы серебра/оксида серебра, методом биотестирования по изменению оптической плотности культуры водоросли хлорелла (таблица 4 – 6). Водная вытяжка, полученная при контакте дистиллированной воды с целлюлозой, содержащей наночастицы оксида серебра (при концентрации нитрата серебраравной 0,005 моль/л), а также водная вытяжка, полученная при контакте дистиллированной воды с полимером (целлюлозой), при синтезе наночастиц серебра с их одновременным закреплением в порах полимера, являются остро токсичными, поскольку средние величины их оптических плотностей по сравнению с контрольным вариантом снижены более, чем на 20 % (62 % и 39 % соответственно). Наблюдаемое снижение, вероятно, вызвано миграцией наночастиц серебра/оксида серебра из полимера (целлюлозы), в связи с ненадежным закреплением их в порах поверхностного слоя полимера. Следовательно, такие материалы нельзя использовать для изготовления упаковок.
Средние величины оптической плотности во всех остальных исследуемых образцах не превышают 20 % от оптической плотности контрольного варианта. Таким образом, полученные материалы, содержащие наночастицы серебра/оксида серебра, являются безопасными для человека и могут быть использованы для изготовления упаковок для пищевых продуктов. Однако в водных вытяжках после контакта дистиллированной воды с полимерами/пленками, полученными при нанесении наночастиц серебра ультразвуком, не было зарегистрировано ни одного снижения средней оптической плотности, более чем на 20 % . Поэтому данный метод нанесения наночастиц на полимер/пленку является самым безопасным по сравнению с другими методами.
Таблица 4 – Результаты измерения острой токсичности водной вытяжки после контакта дистиллированной воды с целлюлозой, содержащей наночастицы оксида серебра
|
Концентрация AgNO3,моль/л |
Полимер с наночастицами оксида серебра (Ag2O) |
Время от начала биотести-рования, ч |
№ по-втор-ности |
Оптическая плотность | Среднее значение оптической плотности |
Процентное отклонение от контроля |
Оценка качества водной вытяжки; оказывает (не оказы-вает) острое токсическое действие |
|
Кон-троль |
- |
22 |
1 2 3 4 |
0,121 0,123 0,121 0,124 |
0,122 |
0 |
- |
|
0,00005 |
Целлюлоза |
22 |
1 2 3 4 |
0,099 0,101 0,099 0,095 |
0,099 |
19 |
не оказывает |
|
0,005 |
Целлюлоза |
22 |
1 2 3 4 |
0,044 0,045 0,044 0,049 |
0,046 |
62 |
оказывает |
Таблица 5 – Результаты измерения острой токсичности водной вытяжки после контакта дистиллированной воды с полимером/пленкой, полученными при синтезе наночастиц серебра с их одновременным закреплением в порах полимера/пленки
| Полимер/пленка с наночастицами серебра |
Время от начала биотес-тирования, ч |
№ по-втор-ности |
Оптическая плотность |
Среднее значение оптической плотности |
Процентное отклонение от контроля |
Оценка качества водной вытяжки; оказывает (не оказывает) острое токсическое действие |
|
Контроль |
22 |
1 2 3 4 |
0,121 0,123 0,121 0,124 |
0,122 |
0 |
- |
|
Целлофан |
22 |
1 2 3 4 |
0,103 0,100 0,100 0,102 |
0,101 |
17 |
не оказывает |
|
Целлюлоза |
22 |
1 2 3 4 |
0,077 0,074 0,071 0,075 |
0,074 |
39 |
оказывает |
Таблица 6 – Результаты измерения острой токсичности водной вытяжки после контакта дистиллированной воды с полимером/пленкой, полученными при нанесении наночастиц серебра ультразвуком
|
Время обра-ботки ультра-звуком, мин |
Полимер/пленка с наночастицами серебра |
Время от начала биотес-тирова-ния, ч |
№ по-втор-ности |
Опти-ческая плотность |
Среднее значение оптической плотности |
Процентное отклонение от контроля |
Оценка качества вод-ной вытяжки; оказывает (не оказывает) острое токсическое действие |
|
- |
Контроль |
22 |
1 2 3 4 |
0,121 0,123 0,121 0,124 |
0,122 |
0 |
- |
|
10 |
Целлофан |
22 |
1 2 3 4 |
0,105 0,101 0,102 0,101 |
0,102 |
16 |
не оказывает |
|
10 |
Целлюлоза |
22 |
1 2 3 4 |
0,099 0,102 0,100 0,102 |
0,101 |
17 |
не оказывает |
|
30 |
Целлофан |
22 |
1 2 3 4 |
0,110 0,113 0,109 0,109 |
0,110 |
10 |
не оказывает |
|
30 |
Целлюлоза |
22 |
1 2 3 4 |
0,106 0,106 0,109 0,107 |
0,107 |
12 |
не оказывает |
Таким образом, исходя из результатов двух методик: по смертности дафний и по изменению оптической плотности культуры водоросли хлорелла, можно сделать окончательную оценку острой токсичности водных вытяжек. Из трех предложенных вариантов: получение наночастиц оксида серебра на целлюлозе; синтез наночастиц серебра с их одновременным закреплением в порах полимера/пленки; нанесение наночастиц серебра на полимер/пленку с помощью ультразвука, самым надежным и безопасным способом нанесения наночастиц оказался последний.
Выводы. Проведено нанесение наночастиц серебра/оксида серебра на образцы целлюлозы и целлофана различными методами, а именно: методом, основанным на синтезе наночастиц оксида серебра с их одновременным закреплением в порах и на поверхности полимера; методом, основанным на синтезе наночастиц серебра с их одновременным закреплением в порах и на поверхности полимера/пленки; методом нанесения раствора наночастиц серебра на полимер/пленку с использованием ультразвука.
Закрепление наночастиц серебра на поверхности пленок установлено методом атомно-силовой микроскопии.
Закрепление наночастиц оксида серебра на поверхности полимеров установлено методом сканирующей электронной микроскопии.
Проведена оценка токсичности полимеров/пленок с наночастицами серебра методами биотестирования по смертности дафний и по изменению оптической плотности культуры водоросли хлорелла. Установлено, что полимер/пленка с наночастицами серебра, нанесенными с помощью ультразвука, являются безопасными и могут быть использованы при изготовлении упаковок для пищевых продуктов с целью продления их сроков хранения.
Библиографический список
- Micbael R. Taylor Assuring the safety of nanomaterials in food packaging: the regulatory process and key issues. Washington: Woodrow Wilson International Center for Scholars, 2008. P. 100.
- Крутяков Ю. А., Кудринский А. А., Оленин А. Ю. // Успехи химии. 2008. № 77 (3). С. 242 – 269 (Krutyakov Yu. A., Kudrinskiy A. A., Olenin A. Yu. // Russian Chemical Reviews. 2003. N. 77 (3). P. 242 – 269).
- Помогайло А. Д., Уфлянд И. Е. Наночастицы металлов в полимерах. М.: Химия, 2000. C. 672.
- Беспалов А. В., Буиклиский В. Д. // Химия и химическая технология. 2012. Т. 55. № 3. С. 59 – 61.
- Panacek А., Kvitek L., Prucek R., Kolar M. //Journal of American Chemical Society. 2006. Vol. 26. № 16. P. 37 – 43.
- Кособудский И. Д., Кульбацкий Д. М., Музалев П. А. и др. // Химия и химическая технология. 2011. Т. 54. № 4. С. 97 – 100.
- Зимон А. Д., Павлов А. Н. Коллоидная химия наночастиц / А. Д. Зимон, А. Н. Павлов. М.: Научный мир, 2012. C. 224.
- ПНД Ф Т 14.1:2:4.12 – 06 Токсикологические методы анализа. Методика определения острой токсичности питьевых, пресных природных и сточных вод, водных вытяжек из почв, осадков сточных вод и отходов по смертности дафний (Daphnia magna Straus).
- ПИД Ф Т 14.1:2:4.10-2004 Токсикологические методы анализа. Методика определения токсичности питьевых, природных и сточных вод, водных вытяжек из почв, осадков сточных вод и отходов производства и потребления по изменению оптической плотности культуры водоросли хлорелла (Chlorella vulgaris Beijer).