Введение
Тиреоидные гормоны (ТГ), как известно, являются одним из важнейших основных факторов регуляции обеспечения нормального развития и функционирования центральной нервной системы (ЦНС) живого организма. ТГ осуществляется ряд жизненно важных процессов, таких как регуляция ά1 – адренорецепторов в коре больших полушарий (КБП) головного мозга (ГМ) крыс. Данными исследованиями доказано, что тиреоидные гормоны регулируют количество ά1 – адренорецепторов на мембране нейронов КБП ГМ крысы, не меняя их связывающей способности (1). Известны исследования связи ТГ с активностью фосфолипазы митохондрий печени крыс с экспериментальным гипертиреозом, показавшие, что однократная инъекция тироксина способствует увеличению активации митохондриальной фосфолипазы (2). Также ТГ осуществляется регуляция транспорта пирувата в митохондриях путем стимуляции глюкогенеза на уровне данного транспорта пирувата из цитозоля в митохондрии, следствием чего является снижение чувствительности к инсулину и увеличение активности инсулинзависимого цитоплазматического регулятора в органах – мишенях инсулина (3). Известны работы по исследованию регуляции ТГ рецепторов для факторов роста, подобных инсулину (4); детально исследован цикл дейодизации тироксина (Т4) и трийодтиронина (Т3) в ГМ крыс (5); влияние Т4 на концентрацию цереброспинальной жидкости (6). В литературе имеются заслуживающие внимания данные относительно влияния ТГ на состав фосфолипидов ткани лёгкого и сурфактанта у крыс. В данных исследованиях у гипотиреоидных крыс методом тонкослойной хроматографии выявили значительное снижение содержания общих липидов, общих фосфолипидов, фосфатидилэтаноламина, фосфатиддилхолина в ткани легкого и общих фосфолипидов и фосфатидилэтаноламина в сурфактанте лёгких. У гипертиреоидных крыс обнаружили значительное повышение вышеуказанных показателей, после систематического шестидневного введения Т4 в определенных дозировках (7). Имеются данные об увеличении Т4 концентрации фактора роста нервов в головном мозге взрослой мыши, согласно которым Т4 приводил к значительному возрастанию концентрации фактора роста нервов в церебральной коре, мозжечке и стволе мозга (8). Несомненный научный интерес представляют данные о влиянии гипо – и гиперпродукции гормонов щитовидной железы (ЩЖ) на морфологическое и функциональное развитие переднего мозга, мозжечка, периферической нервной системы, рост нейритов в культуре ткани, формировании синапсов, микротрубочек, развитие астро – и олигодендроглии, шванновских клеток и миелинизации, а также роль ТГ в становлении энергетического, белкового и нуклеопротеидного метаболизма в ЦНС и формировании систем “нейромедиаторы – рецепторы” (9). В литературе имеются данные относительно применения экзогенных ТГ, приводящих к улучшению функционального восстановления после травмы периферической нервной системы и ЦНС (10). Другие научные исследования свидетельствуют о небольшом улучшении функционального восстановления в повреждённом спинном мозге (СМ) крыс при действии экзогенного Т3 в течение двух недель после спинномозгового повреждения (11, 12). На животных с латеральной гемисекцией (ЛГМС) СМ и действием Т4 показано быстрое восстановление соматических функций, сопровождающееся более выраженной гипертрофией нейронов и разрастанием нервных волокон, а также наличием слабо выраженных дистрофических и рубцовых изменений в поврежденной области СМ (13). Нашими исследованиями на крысах, подверженных ЛГМС и действию Т4, и с регистрацией электрической активности спинномозговых потенциалов были получены предварительные данные, указывающие на активирующее действие гормона ЩЖ (14). В наших последующих исследованиях была подробно изучена роль Т4 в изменении электрической активности интернейронов и мотонейронов повреждённого СМ крыс и был представлен подробный анализ данных, касающихся влияния Т4 на изменение электрической активности нейронов СМ крыс в норме и при патологии (15).
Известно, что компенсаторные приспособления в повреждённом организме осуществляются благодаря сложному синтезу многообразных, взаимодействующих в организме и в особенности в ЦНС процессов, к которым относится в частности регенерация повреждённых структур (16). Одним из актуальных вопросов современной физиологии и медицины является вопрос о состоянии восстановительных процессов при повреждениях СМ у млекопитающих при воздействии различных препаратов. Особый интерес представляет применение ферментных препаратов (ФП) при органических повреждениях СМ. Ферментами являются биологические катализаторы, ускоряющие биологические процессы внутри клетки. Они представляют собой белки, в молекуле которых имеется один или несколько участков для прикрепления субстрата, т. е. вещества, подвергающегося действию данного фермента. Ферментативная активность в отличие от действия неорганических катализаторов является специфичной, т. е. каждый фермент способен действовать на один определенный тип субстрата. Первейшей предпосылкой поставленной нами в проведении подобного рода исследований – поиск оптимального средства стимулирующего и благоприятствующего росту волокон повреждённых путей СМ. Основываясь на данном утверждении, нами, учитывая особенности биохимических, гистохимических и морфологических процессов поврежденного СМ и ферментных систем, поставили перед собой цель – найти препараты и способы воздействий, которые с одной стороны ингибируют рост рубцовой ткани, с другой – благоприятствуют и стимулируют рост нервных волокон с тем, чтобы добиться восстановления проводимости СМ. Выбор фермента лидазы (ЛД) в данных сериях научных исследований обусловлен фактом наличия в качестве основного компонента соединительной ткани гиалуроновой кислоты (высокомолекулярного полисахарида) входящей в состав межтканевого и межклеточного вещества, выполняющей роль “цементирующего” агента и играющей важную роль в регуляции тканевой проницаемости (17 – 19). ЛД – это ферментный препарат гиалуронидазного действия, синтезированный в 1958 г. В. А. Алферьевой. Было показано, что в связи с расщеплением гиалуроновой кислоты соединительной ткани ЛД активно тормозиться процесс послеоперационного рубцевания, что приводит к образованию очень тонкого и рыхлого рубца. Этот фермент оказывал благотворное действие при лечении келоидных рубцов, рубцовом сужении мочеточника, контрактур, склеродермии и других затвердений, вызванных развитием соединительной ткани. Под влиянием ЛД гиалуроновая кислота, как вне организма, так и в тканях организма деполимеризуется и расщепляется. Сначала разрушается связь между полисахаридной и белковой частью. Следующая фаза – деполимеризация со снижением вязкости, и, наконец, гидролиз с разрушением глюкозидной связи между кислотой и ацетилглюкозамином. Фаза деполимеризации гиалуроновой кислоты сопровождается уменьшением ее вязкости, что приводит к увеличению проницаемости тканей и межклеточного вещества, а также последующем торможением образования коллагеновых волокон.
Известно, что холин (от греч. сholy – жёлчь), гидроокись 2 – оксиэтилтриметиламмония, [(CH3)3N+CH2CH2OH] OH-. Бесцветные кристаллы, хорошо растворимые в воде, этиловом спирте, нерастворимые в эфире, бензоле. Холин легко образует соли с сильными кислотами, его водные растворы обладают свойствами сильных щелочей. Впервые получен из жёлчи. Широко распространён в живых организмах. Особенно высоко содержание его в яичном желтке, мозге, печени, почках и мышце сердца. Холин обычно относят к витаминам группы В, хотя животные и микроорганизмы способны его синтезировать. Холин входит в состав фосфолипидов (например, лецитина, сфингомиелина), служит источником метильных групп в синтезе метионина. Из холина в организме животных синтезируется ацетилхолин – один из важнейших химических передатчиков нервных импульсов. Холин является так называемым липотропным веществом, предотвращает тяжёлые заболевания печени, возникающие при её жировом перерождении. В медицине для лечения заболеваний печени применяют хлорид холина (20 – 22). Его вводят также в состав комбикормов сельскохозяйственных животных. Для аналитических целей используют способность холина давать плохо растворимые соли с фосфорновольфрамовой, платинохлористоводородной и некоторыми другими гетерополикислотами (23 – 29). Холин является аминоспиртом, химическим веществом близким по своему строению к фосфатидовым кислотам, наиболее простой форме фосфолипидов, которые, как известно, служат главными компонентами биологических мембран (30). Отличительным признаком фосфатидовых кислот является наличие остатка фосфорной кислоты, который образует сложноэфирную связь с гидроксильной группой sn – С – З глицерина. Поэтому фосфолипиды по крайней мере в нейтральной области рН несут отрицательный заряд. Наиболее простая форма фосфолипидов, фосфатидовые кислоты, являются фосфо – моноэфирами диацилглицерина. Фосфатидовые кислоты – важнейшие предшественники в биосинтезе жиров и фосфолипидов. Фосфатидовые кислоты могут быть получены из фосфоглицеридов с помощью фосфолипаз. Фосфатидовая кислота (остаток фосфатидил –) служит исходным веществом для синтеза других фосфолипидов. Остаток фосфорной кислоты может образовывать сложноэфирную связь с гидроксильными группами аминоспиртов (холин, этаноламин или серин) или полиспиртов (миоинозит) Холин является предшественником ацетилхолина – одного из передатчиков нервных импульсов, или нейромедиаторов (31). Для синтеза нейромедиатора ацетилхолина нервная ткань получает холин извне, поскольку он в мозге практически не синтезируется и поступает туда из крови через гематоэнцефалический барьер. Часть холина используется для ресинтеза лецитина и убихинона, другая часть в холинергических нейронах – для синтеза ацетилхолина. Внутриклеточное содержание холина в ткани мозга составляет больше 50 %, остальная часть холина захватывается терминалями из синаптической щели после гидролиза и используется повторно. Захваченный холинергическими терминалями холин (60 – 72 %) сразу превращается в ацетилхолин (32). Биосинтез холина осуществляется путём метилирования N – диметиламиноэтанола, синтезируемого из серина (33).
В коррегировании соматических и нейрогенных нарушений невторостепенна роль эфиров и амидов холина, заслуживающих существенного внимания с точки зрения особенностей их синтеза и биологической активности (34). Согласно результатам данных исследований холиновыми эфирами и амидами осуществляется ряд важнейших функций в организме человека и животных. Вместе с тем продолжают отсутствовать сведения относительно применения эфиров и амидов холина при спинномозговых повреждениях различной степени выраженности и результатов их действия на нейроны СМ и ГМ.
В связи с этим, нами предложена экспериментальная клиническая модель, описывающая сочетанное использование ФП ЛД, гормона ЩЖ – Т4 и синтезированного нами производного холина йодметилата 2 – (диметиламино) этилового эфира N – (п – метоксибензоил) – D, L – фенилаланина (ИДФ) при ЛГМС СМ крыс с регистрацией в режиме on-line фоновой электрической активности (ФА) одиночных пирамидных нейронов (ПН) КБП ГМ. Целесообразность использования Т4 и ИДФ в данной модели обусловлена их ролью как стимуляторов обменных процессов в повреждённых клетках, со стимуляцией роста аксонов, по которым восстанавливается проводимость импульсов от периферии к КБП. Накопившейся за последние годы экспериментальный и клинический материал дает основания для некоторых обобщений, касающихся как физиологического действия Т4 и ИДФ, так и специфичности их влияния на обменные процессы.
Материал и методы
Эксперименты были поставлены на 80 белых крысах – самцах (массой 200 – 240 г.), разделенным на 3 группы: первая – 20 экземпляров – интактные животные; вторая – 30 экземпляров – животные с ЛГМС СМ, не получавшие сочетанного комплекса препаратов; третья – 30 экземпляров – животные с ЛГМС СМ, получавшие в течение 1 месяца сочетанные инъекции ФП ЛД, Т4 и ИДФ в место повреждения ( ЛД – из расчета 32 ед/кг; Т4 – 200 мкг/кг массы животного; ИДФ – 200 мкг/кг массы животного). Животные оперировались в стерильных условиях под хлоралозо – нембуталовым наркозом. Под брюхо наркотизированного животного подкладывался небольшой валик и передние лапы подтягивались к задним. В грудной части спины выстригали и выбривали шерсть, затем смазывали кожу йодом. Операционное поле обкладывалось стерильными салфетками, после чего производили разрез по линии остистых отростков на уровне отделов Т8 – Т9 позвоночника. Мышцы по сторонам отростков отслаивались в стороны до самых дужек позвонков. Маленькими костными щипцами резецировались остистые отростки двух позвонков, специальными крючками раздвигались дужки позвонков. С помощью утонченного катарактального скальпеля производили ЛГМС СМ на вышеуказанном уровне. Затем приостанавливали кровотечение с помощью местного кровоостанавливающего средства с последующим тщательным орошением физиологическим раствором. После этого узловыми швами сшивали мышцы и кожу. Всего было прооперированно 60 крыс. За каждым животным велись индивидуальные клинические наблюдения. Проводилась каждодневная проверка состояния животных, с соответствующей регистрацией в специальных протоколах наблюдений.
Проведенные исследования показали, что у крыс после ЛГМС СМ выявляется Броун – Секаровский паралич, выражающийся нарушением локомоции задних конечностей, особенно левой. Однако местные спинальные рефлексы при этом сохранялись. Так, в ответ на постукивание крестцовой кости возникали рефлекторные движения, сильнее выраженные со стороны левой задней конечности, чем правой. Помимо того, слева, то есть на стороне операции ниже уровня ЛГМС, понижалась также тактильная чувствительность, но повышалась возбудимость на болевые (укол булавкой, щипки пинцетом) раздражители. Между тем на правой, то есть противоположной операции стороне тела, ниже уровня ЛГМС, отмечалось падение возбудимости при раздражении гальваническим или индукционными токами. Наблюдались изменения и кожной температуры задних конечностей, выражающиеся повышением слева при отсутствии существенных изменений справа. Наблюдаемые нарушения постепенно проходили, причем вначале двигательные с контралатеральной операции стороны, затем ипсилатеральной, потом исчезали чувствительные нарушения.
После завершения дачи препаратов на всех 3 группах животных были поставлены электрофизиологические эксперименты. Микроэлектрофизиологическими методами с применением стеклянных микроэлектродов (диаметр кончика 2 – 4 микрон, заполненных 2М раствором NaCl) производилась регистрация ФА одиночных ПН КБП ГМ в I – IV слоях КБП ГМ крыс. Анализ ФА данных ПН производили посредством использования специальных программ на компьютере (on – line). Выборка спайков проводилась с помощью амплитудного дискриминатора посредством программного анализа.
Результаты и обсуждение
В данных сериях исследований проводилась запись внеклеточной ФА одиночных ПН в I – IV слоях (1 и 2 –ые сенсомоторных зоны) КБП ГМ крыс у всех 3 – х групп экспериментальных животных. Результаты исследований показали стойкий эффект нормализации ФА одиночных ПН КБП ГМ у крыс 3 – ей группы, после систематического введения сочетанного комплекса препаратов в определенных вышеуказанных дозировках.
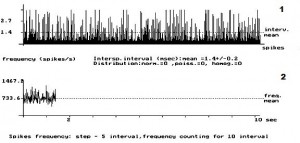
- Рис. 1. Кумулятивная внеклеточная фоновая электрическая активность одиночного пирамидного нейрона IV слоя коры больших полушарий головного мозга у интактных крыс. 1 – абсцисса – число импульсов, ордината – межимпульсные интервалы импульсного потока; 2 – расчёт средней частоты данного нейрона.
-
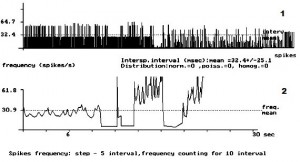
- Рис. 2. Кумулятивная внеклеточная фоновая электрическая активностьодиночного пирамидного нейрона IV слоя коры больших полушарий головного мозга у крыс с латеральной гемисекцией спинного мозга. 1 – абсцисса – число импульсов, ордината – межимпульсные интервалы импульсного потока; 2 – расчёт средней частоты данного нейрона.
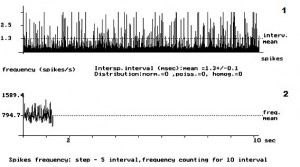
- Рис. 3. Кумулятивная внеклеточная фоновая электрическая активность одиночного пирамидного нейрона IV слоя коры больших полушарий головного мозга у крыс с латеральной гемисекцией спинного мозга, получавших сочетанный комплекс препаратов. 1 – абсцисса – число импульсов, ордината – межимпульсные интервалы импульсного потока; 2 – расчёт средней частоты данного нейрона.
На рис. 1 представлена картина внеклеточной ФА одиночного ПН в IV слое КБП ГМ у интактных крыс. На данном рисунке внеклеточная ФА данного нейрона представлена регулярным типом разряда ПН. Рис. 2 демонстрирует изменение внеклеточной ФА одиночных ПН КБП ГМ в IV слое при органическом повреждении СМ – ЛГМС. В записи ФА одиночных ПН сенсомоторных зон коры больших полушарий головного мозга у животных 2 – ой группы полностью отсутствует картина нормализации ФА одиночных ПН и происходит её резкое урежение с возникновением патологического «пачечного» типа разряда ПН, вызванное, вероятно, интесивностью спинального повреждения. На рис. 3 представлен эффект нормализации внеклеточной ФА одиночного ПН IV слоя КБП ГМ у крыс с ЛГМС, получавших комплекс препаратов с переходом её в регулярный тип разряда ПН. В записи ФА в I – IV слоях КБП ГМ крыс мы наблюдали следующий феномен – у животных 3 – ей группы (рис. 3) картина ФА одиночных ПМ КБП во всех вышеуказанных её слоях приближается к таковой у животных 1 – ой группы (рис. 1). Это свидетельствует, вероятно, о стойких процессах восстановления внеклеточной ФА одиночных ПН КБП ГМ у животных, получавших ежедневные инъекции комплекса препаратов. Проведенные нами исследования, показали, что у животных с ЛГМС СМ, получавшим инъекции сочетанного комплекса препаратов в место повреждения, наблюдается наиболее стойкая картина восстановления внеклеточной ФА ПН КБП ГМ крыс. У крыс с ЛГМС СМ (2 группа) не получавших данного комплекса препаратов картина восстановления выражена значительно хуже. На основании проведенных исследований можно сделать вывод о целесообразности применения гормона ЩЖ Т4, фермента ЛД и холинового эфира ИДФ при органических повреждениях СМ, что иллюстрируется поведением одиночных пирамидных нейронов сенсомоторных зон КБП ГМ в I – IV слоях.
Многолетняя практика исследований подтверждает эффективность применения различных сочетаний ФП при органических повреждениях СМ. Имеются данные об изучении разной ферментотерапии на функционально – структурное состояние СМ при его полной перерезке (35), а также данные о гисто – физиологической характеристике полностью перерезанного СМ при применении лидазы, прозерина, пирогенала, стрихнина (36). Эффекты Т4 и ИДФ на ЦНС можно рассматривать в различных аспектах, что связано, с одной стороны, с многообразием структурных уровней нервной системы, а с другой – с многообразием функций, выполняемых ЦНС в организме животных.
Данная экспериментальная клиническая модель имеет свои преимущества даже по сравнению с животными, в отдельности получавшими инъекции либо ЛД, либо гормона ЩЖ – Т4, либо холинового эфира ИДФ. Она является, по нашему мнению, наиболее оптимальным сочетанием, которое может применяться при органических повреждениях СМ.
Библиографический список
- Gerhard G., Brodde O. E., Shumman H. J. Regulation of ά 1 – adrenoceptors in the cerebral cortex of the rat by thyroid hormones. “Naunyn – Schmiedberg’s Arch. Pharmacol”, 1981, 316, N1, pp. 45 – 50.
- Марзоев А. И., Андрющенко А. П., Владимиров Ю. А. Тиреоидные гормоны и активность фосфолипазы митохондрий печени крыс. “Бюл. эксперим. и биол. мед.”, 1983, 96, N12, с. 45 – 46.
- Таракулов Я. Х., Мирмахмудова С. И., Гайнутдинов М. Х. Регуляция транспорта пирувата в митохондриях тиреоидными гормонами. “Бюл. эксперим. и биол. мед.”, 1983, 96, N9, с. 57 – 59.
- Pfeifle B., Ditschuneit H. Regulation of receptors of insulin – like growth factors by thyroid hormone. “Acta Endocrinol.”, 1983, 103, Suppl. N256, 67.
- Tanaka K et al. Inner ring monodeiodination of thyroxine and 3, 5, 3’ – L – triiodothyronine in rat brain. “Endocrinology”, 1981, 109 (5), pp. 1619 – 1624.
- Kassem N. A., Deane R., Segal M. B. Efflux of thyroxine and its brain distribution from the cerebrospinal fluid. Abstracts,.Conf. of Neurosci., 1985, Greenwich, UK.
- Kumar Ratan, Hegde K. S. Influence of thyroid hormones on the phospholipids composition of lung tissue and surfactant of rats. “Indian J. Physiol. and Pharmacol.”, 1983, 27, N3, pp. 203 – 208.
- Walker P. et al. Thyroxine increases nerve growth factor concentration in adult mouse brain. “Science”, 1979, 204, N4391, pp. 427 – 429.
- Legrand J. Hormones thyroidiennes et maturation du systeme nerveux. “J. Physiol.” (Fr.), 1982 – 1983, 78, N7, 603 – 652.
- Cook R. A., Kiernan J. A. Effects of triiodthyronine on protein synthesis in regenerating peripheral neurons. Exp. Neurol., 1976, 52, 515 – 524.
- Tator C. H., Van der Jagt R. A. C. The effect of exogenous thyroid hormones on functional recovery of the rat after acute spinal cord compression injury. J. Neurosurg., 1980, 53, 381 – 384.
- Tator C. H., Rivlin A. S., Lewis A. G., Schmoll B. Effects of triiodo – L – thyronine on axonal regeneration in the rat spinal cord after acute compression injury. J. Neurosurg., 1983, 58, 406 – 409.
- Матинян Л. А, Аллавердян А. Г. Роль тиреоидных гормонов в состоянии пластичности у грызунов при повреждении спинного мозга. 7 научное совещвние по эволюционной физиологии, посвященное памяти академика Л. А. Орбели, Л., 1978, с. 154 – 155.
- Kipriyan T. K., Matinyan L. A., Andreasian A. S., Chavushian V. A. Thyroxine influence on the electric activity of spinal cord neurons of rats in norm and in pathology. 1st Conference of the Armenian IBRO Association, Yerevan, RA, 1996, pp. 41 – 42.
- Хачатрян Т. С., Матинян Л. А., Андреасян А. С., Киприян Т. К. Роль тироксина в изменении электрической активности интернейронов и мотонейронов поврежденного спинного мозга крыс. Ж. Вопросы теоретической и клинической медицины, 2002, т.5, N1 (25), с. 40 – 45.
- Асратян Э. А. К теории компенсации функций. В кн.: “Проблема компенсаторных приспособлений”. Изд. АН СССР, М., 1960, с. 235 – 245.
- Музыкант Л. И. Гистохимическое определение гиалуроновой кислоты при некоторых патологических состояниях. В кн.: “Конференция научных работников биохимических лабораторий институтов травматологии, ортопедии и восстановительной хирургии”. Тез. докл., М., 27, 28, 1956.
- Касавина Б. С., Музыкант Л. И. Влияние гиалуронидазы на образование волокнистых структур в процессе заживления ран. ДАН СССРБ 1958, 123, 1, с. 189 – 191.
- Матинян Л. А. Восстановление функций полностью перерезанного спинного мозга при ферментотерапии. В сб.: “Травмы позвоночника и спинного мозга (клиника и комплексное восстановительное лечение).”. Л., 1965, с. 148 – 155.
- Holmes – McNary M. Q., Cheng W. L., Mar M. H., Fussel S., Zeisel S. H. Choline and choline esters in human and rat milk and in infant formulas. J. Am. J. Clin. Nutr., 1996, № 64, v. 4, pp. 572 – 576.
- Brown M., Davies I. M., Moffat C. F., Redshaw J., Craft J. A. Characterisation of choline esterases and their tissue and subcellular distribution in mussel (Mytilus edulis). J. Mar. Environ. Res., 2004, № 57, v. 3, pp. 155 – 169.
- Maestro B., Gonzalez A., Garcia P., Sanz J. M. Inhibition of pneumococcal choline-binding proteins and cell growth by esters of bicyclic amines. J. FEBS, 2007, № 274, v. 2, pp. 364 – 376.
- Zeisel S. H. Nutritional Importance of Choline for Brain Development. J. Am. J. Clin. Nutr., 2004, № 90006, pp. 621 – 626.
- Zeisel S. H. Choline: Needed for Normal Development of Memory. J. Am. J. Clin. Nutr., 2000, № 9005, v. 19, pp. 528 – 531.
- Zelder F. H., Salvio R., Rebek J. Jr. A synthetic receptor for phosphocholine esters. J. Chem. Commun. (Camb.), 2006, № 28, v. 12, pp. 1280 – 1282.
- Eibl K. H., Lewis G. P., Betts K., Linberg K. A., Gandorfer A., Kampik A., Fisher S. K. The effect of alkylphosphocholines on intraretinal proliferation initiated by experimental retinal detachment. J. Invest. Ophtalmol. Vis. Sci., 2007, № 48, v. 3, pp. 1305 – 1311.
- Masson P., Froment M. T., Gillon E., Nachon F., Lockridge O., Schopfer L. M. Hydrolysis of oxo- and thio-esters by human butyrylcholinesterase. J. Biochim. Biophys. Acta, 2007, № 1774, v. 1, pp. 16 – 34.
- Carrasco M. P., Jimenes – Lopez J. M., Segovia J. L., Marco C. Hexadecylphosphocholine interferes with the intracellular transport of cholesterol in HepG2 cells. J. FEBS, 2008, № 275, v. 8, pp. 1675 – 1686.
- Di Venosa G., Hermida L., Battle A., Fukuda H., Defain M. V., Mamone L., Rodriguez L., MacRobert A., Casas A. Characterisation of liposomes containing aminolevulinic acid and derived esters. J. Photochem. Photobiol., 2008, № 92, v. 1, pp. 1 – 9.
- Ilcol Y. O., Yilmaz Z., Cansev M., Ulus I. H. Choline or CDP-choline alters serum lipid responses to endotoxin in dogs and rats: involvement of the peripheral nicotinic acetylcholine receptors. J. Shock, 2008, № 22, v. 1, pp. 20 – 25.
- Lillesaar C., Stigloher C., Tannhauser B., Wullimann M. F., Bally – Cuif L. Axonal projections originating from raphe serotonergic neurons in the developing and adult zebrafish, Danio rerio, using transgenics to visualize raphe-specific pet1 expression. J. Comp. Neurol., 2009, № 512, v. 2, pp. 158 – 182.
- Глебов Р. Н., Крыжановский Г. Н. Функциональная биохимия синапсов. 1978. М., Медицина, с. 196 – 219.
- Iasnetsov V. V., Pravdivtsev V. A., Motin V. G., Karsanova S. K., Ivanov Iu. V. Modification by various neuromediators and regulatory peptides of the impulsation activity of neurons in the medial vestibular nucleus. J. Aviakosm. Ekolog. Med., 2008, № 42, v. 3, pp. 61 – 63.
- Bottcher C., von Roepenack – Lahaye E., Schmidt J., Clemens S., Scheel D. Analysis of phenolic choline esters from seeds of Arabidopsis thaliana and Brassica napus by capillary liquid chromatography/electrospray- tandem mass spectrometry. J. Mass spectrum., 2009, № 44, v. 4, pp. 466 – 476.
- Матинян Л. А. Сравнительное изучение разной ферментотерапии на функционально – структурное состояние спинного мозга при его полной перерезке. В кн.: “Механизмы регенерации и клеточного деления”. М., “Медицина”, 1971, 105.
- Матинян Л. А., Андреасян А. С., Епремян Г. А. Гисто – физиологическая характеристика полностью перерезанного спинного мозга при применении лидазы, прозерина, пирогенала, стрихнина. В кн.: “Материалы 9 – ой объединенной научной конференции пед. ин – тов закавказских республик по проблемам физиологии”. Сухуми, 1965, с. 70 – 72.
