Введение
Жидкофазное каталитическое окисление органических веществ газообразным кислородом часто применяется для получения ряда кислородсодержащих веществ. В связи с этим вопросам теории и практики жидкофазного окисления посвящено множество работ, особенно опубликованных с 30-х годов ХХ века. На сегодняшний день практически полностью изучены некаталитические процессы жидкофазного окисления ароматических углеводородов. Большое внимание уделяется гомогенному катализу этих процессов. Однако до сих пор отсутствуют исследования, результаты которых сводят воедино основные закономерности каталитических реакций, идущих с участием углеводородов различной структуры, и их кислородсодержащих производных.
В планируемой работе будет сделана попытка объединения множества наблюдений в рамках единой концепции, снимающей ряд противоречий в представлениях о жидкофазном окислении ароматических соединений. Плодотворность такого объединения уже была показана на примере этилбензола и наглядно подтверждена созданием общей кинетической модели окисления этилбензола и его кислородных производных, адекватно описывающей процесс до глубоких конверсий исходного вещества [1]. В данной работе показано, что гидропероксидный радикал вовлекает углеводород в цепной процесс окисления, однако, вопреки традиционной схеме, каталитический распад гидропероксида не является источником инициирования. В этой роли выступает реакция взаимодействия высшей валентной формы металла-катализатора с ацетофеноном (для марганца) или с метилфенил карбинолом (для кобальта). Бензойная кислота при этом образуется только при катализе марганцем, так как кобальт практически не вступает во взаимодействие с кетоном.
В связи с этим представляет интерес сравнение реакций окисления этилбензола и его изомера пара-ксилола (ПК), не содержащего вторичного атома углерода в боковой цепи, т.е. в реакционной системе, не включающей кетоны и вторичных спирты.
Методика эксперимента
Пара-ксилол марки «ч» очищали от следов перекисных соединений пропусканием его через колонку, заполненную окисью алюминия, с последующей перегонкой в атмосфере аргона. Использовалась фракция, кипящая при температуре 134,5-135,5 °С. Очищенный этилбензол хранили в банках темного стекла.
Стеарат кобальта Со(С17Н35СОО)2 (молекулярный вес 624,9). Использовали готовый продукт марки «ч.д.а.».
Стеарат марганца. Использовали готовый продукт марки «ч.д.а.».
Пара-толуиловый спирт. Использовали готовый продукт 98% марки «ч» фирмы Acros Organics, Бельгия.
Гидропероксид пара-ксилола марки «ч.д.а.» использовали без дополнительной подготовки.
Пара-дихлорбензол. Использовали готовый продукт 99% марки «ч» фирмы Acros Organics, Бельгия.
ПК окисляли в кинетической области кислородом воздуха в реакторе периодического действия в присутствии стеаратов кобальта и марганца.
Схема лабораторной установки для окисления ПК при атмосферном давлении приведена в работе [1]. По ходу реакции через определенные промежутки времени отбирали пробы оксидата, в которых анализировали все основные компоненты реакционной смеси.
За начало эксперимента принимали момент подачи воздуха в реактор, в котором находился раствор окисляемого углеводорода с катализатором, нагретый до соответствующей температуры. За начальную скорость окисления ПК принималась скорость расходования ПК после завершения индукционного периода, чему соответствовало фиксируемое визуально окрашивание раствора в интенсивно-зеленый (переход кобальта в трехвалентную форму) или темно-коричневый (переход марганца в трехвалентную форму) цвет. Начальная скорость расходования ПК измерялась методом графического дифференцирования.
Концентрации пара-толуилового спирта (ПТС) и пара-толуилового альдегида (ПТА), образующихся в результате окисления, определяли хроматографическим методом. Концентрации гидропероксида пара-ксилола (ГП ПК) и пара-толуиловой кислоты (ПТК) определяли методом титрования. Концентрации валентных форм катализатора анализировались спектрофотометрическим методом.
Окисление ПК в присутствии стеарата кобальта
Материальный баланс окисления ПК
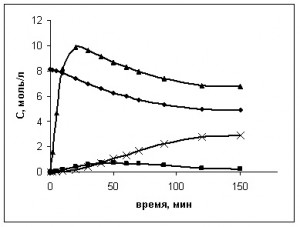
Материальный баланс окисления ПК устанавливали при следующих начальных концентрациях компонентов СПК=8,11 моль/л, С(CoSt2)=0,0016 моль/л. Температура процесса 120оС. Результаты представлены в табл. 1 и на рис. 1.
Таблица 1
Результаты эксперимента по окислению ПК, [CoSt2]0=0,0016моль/л
|
Время, мин |
Концентрации, моль/л |
||||
|
ПК |
ПТА |
ПТС*100 |
ПТК |
Со3+ |
|
|
0 |
8,11 |
0 |
0 |
0 |
0 |
|
2 |
8,1019 |
0,0039 |
0,3983 |
0,000217 |
0,000534 |
|
5 |
8,081 |
0,01414 |
1,3626 |
0,001234 |
0,001015 |
|
10 |
8,0376 |
0,0327 |
3,0799 |
0,008901 |
0,001385 |
|
20 |
7,978 |
0,0769 |
5,6 |
0,009 |
0,00157 |
|
30 |
7,8472 |
0,1089 |
7,82 |
0,0757 |
0,001596 |
|
40 |
7,793 |
0,137 |
8,43 |
0,0957 |
0,001599 |
|
50 |
7,637 |
0,156 |
9,44 |
0,2226 |
0,001599 |
|
60 |
7,588 |
0,1767 |
9,52 |
0,2501 |
0,001599 |
|
70 |
7,451 |
0,179 |
9,6 |
0,384 |
0,0016 |
|
90 |
7,324 |
0,188 |
9,76 |
0,5004 |
0,0016 |
|
120 |
7,012 |
0,1899 |
9,56 |
0,8125 |
0,0016 |
|
150 |
6,837 |
0,184 |
9,11 |
0,9979 |
0,0016 |
Очевидно, что продуктами окисления ПК оказываются вещества, описанные в литературных источниках [2], а ошибка схождения материального баланса не превышает 1,5 мас.%.
Рис. 1 Кинетические кривые окисления ПК. Кривая накопления гидропероксида не показана. ● – ПК; ▲ – ПТА; ■ – ПТС·100; D– ПТК; [CoSt2]0=0,0016 моль/л
Экспериментальные данные показывают, что образование спирта и альдегида происходит параллельным путем, оба эти вещества являются промежуточными продуктами окисления ПК, а конечным продуктом оказывается кислота. Исходя из общих представлений о схеме окисления углеводородов, можно предположить следующую схему окисления ПК до ПТК:
На рис. 2 представлены кривые количества израсходованного ПК (1) и суммарного количества образовавшихся органических продуктов реакции (2).
Рис. 2. Расходование ПК (♦ – 1) и накопление продуктов реакции (■ – 2)
Как видно из рис. 2, кривые практически совпадают. Это говорит о том, что основные продукты реакции обнаружены, и материальный баланс по компонентам сведен с достаточной точностью.
Влияние начальных концентраций реагентов и катализатора на окисление ПК
Для выяснения роли катализатора и природы каталитического эффекта в окислении ПК проводили однофакторный эксперимент, изменяя начальные концентрации ПК и катализатора, а также проводя реакцию в присутствии добавок ГП ПК, ПТС, ПТА И ПТК. Сравнение результатов проводили по начальным скоростям расходования ПК, причем за начальную скорость принимали тангенс угла наклона касательной к кинетической кривой в момент окончания периода индукции.
Изменение начальной концентрации ПК проводили путем разбавления реакционной массы инертным растворителем – пара-дихлорбензолом. Кинетические кривые приведены на рис. 3.
Рис. 3. Кинетические кривые окисления ПК при изменении его начальной концентрации, моль/л: ▲ – 8,11; ■ – 5; ● – 4.
[CoSt2]0=0,0016 моль/л
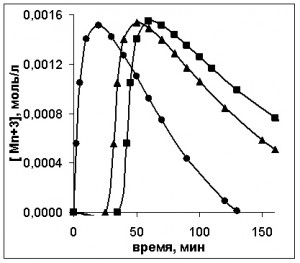
Видно, что со снижением начальной концентрации углеводорода уменьшается и начальная скорость окисления, тогда как период индукции увеличивается.
Увеличение периода индукции сказывается на кривых всех компонентов реакционной массы, включая катализатор. Как показано на рис. 4, резко снижается скорость накопления его активной трехвалентной формы, но затем, независимо от начальной концентрации углеводорода, металл полностью переходит в трехвалентную форму.
Рис. 4. Кинетические кривые изменения концентрации активной формы катализатора при изменении начальной концентрации ПК, моль/л: ▲ – 8,11; ■ – 5; ● – 4. [CoSt2]0=0,0016 моль/л
Влияние концентрации катализатора на скорость окисления ПК
Увеличение концентрации катализатора приводит к возрастанию продолжительности индукционного периода и к увеличению начальной скорости окисления после его окончания. Концентрация трехвалентной формы кобальта достигает максимального значения, равного начальной концентрации CoSt2, к моменту начала ускоренного расходования ПК.
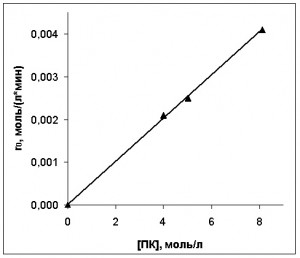
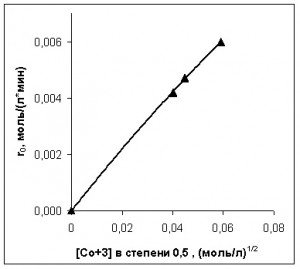
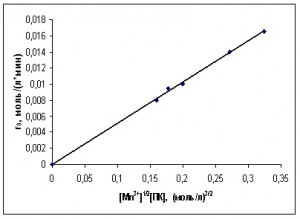
Зависимости начальной скорости реакции от концентраций ПК и катализатора приведены на рис. 5 и 6.
Рис. 5. Зависимость начальной скорости окисления ПК от начальных концентраций ПК
Рис. 6. Зависимость начальной скорости окисления ПК от начальных концентраций катализатора
Судя по рис. 5 и 6, начальная скорость расходования углеводорода зависит от концентраций ПЛ и кобальта следующим образом:
где rПК0 – начальная скорость окисления ПК (моль/(л·мин));
[Со3+]0 – концентрация трехвалентной формы кобальта в начальный момент развитого процесса окисления; (моль/л);
[ПК]0 – концентрация ПК в начальный момент развитого процесса окисления (моль/л);
k=0,0122 л1/2/(моль1/2·мин).
Окисление ПК в присутствии стеарата марганца
Материальный баланс окисления ПК
Материальный баланс окисления ПК устанавливали при следующих начальных концентрациях компонентов СПК=8,11 моль/л, С(MnSt2)=0,0016 моль/л. Температура процесса 120оС. Результаты представлены в табл. 2 и на рис. 7.
Таблица 2
Результаты эксперимента по окислению ПК, [Mn St2]0=0,0016моль/л
|
Время, мин |
Концентрации, моль/л |
||||
|
ПК |
ПТА |
ПТС*100 |
ПТК |
Mn3+ |
|
|
0 |
8,11 |
0 |
0 |
0 |
0 |
|
2 |
8,077 |
0,017 |
1,546 |
0,001 |
0,000559 |
|
5 |
7,988 |
0,069 |
4,662 |
0,006 |
0,001048 |
|
10 |
7,799 |
0,194 |
8,176 |
0,035 |
0,001401 |
|
20 |
7,378 |
0,450 |
9,892 |
0,183 |
0,001515 |
|
30 |
6,970 |
0,617 |
9,623 |
0,426 |
0,001423 |
|
40 |
6,597 |
0,697 |
9,141 |
0,725 |
0,001272 |
|
50 |
6,263 |
0,715 |
8,683 |
1,044 |
0,001099 |
|
60 |
5,970 |
0,694 |
8,278 |
1,363 |
0,00092 |
|
70 |
5,716 |
0,649 |
7,925 |
1,666 |
0,000747 |
|
90 |
5,316 |
0,525 |
7,370 |
2,196 |
0,000436 |
|
120 |
4,959 |
0,317 |
6,876 |
2,765 |
9,31E-05 |
|
150 |
4,909 |
0,242 |
6,806 |
2,891 |
1,39E-05 |
Очевидно, что продуктами окисления ПК оказываются вещества, описанные в литературных источниках, а ошибка схождения материального баланса не превышает 1,5 мас.%.
Рис. 7 – Кинетические кривые окисления ПК. Кривая накопления гидропероксида не показана. ● – ПК; ■ – ПТА; ▲ – ПТС·100; ×– ПТК; [CoSt2]0=0,0016 моль/л
Экспериментальные данные показывают, что общая схема превращения веществ аналогична схеме окисления в присутствии кобальта: образование спирта и альдегида происходит параллельным путем, оба эти вещества являются промежуточными продуктами окисления ПК, а конечным продуктом оказывается кислота. Однако оказывается очевидным то, что начальная скорость окисления ПК в присутствии марганца существенно выше, чем при катализе кобальтом, но кинетические кривые обнаруживают торможение по мере протекания реакции вплоть до практически полной остановки процесса.
На рис. 8 представлены кривые количества израсходованного ПК (1) и суммарного количества образовавшихся органических продуктов реакции (2).
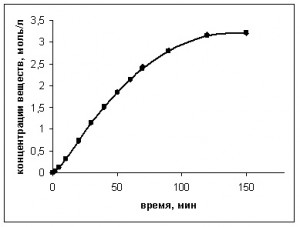 Рис. 8. Расходование ПК (♦ – 1) и накопление продуктов реакции (■ – 2) при окислении ПК в присутствии стеарата марганца
Рис. 8. Расходование ПК (♦ – 1) и накопление продуктов реакции (■ – 2) при окислении ПК в присутствии стеарата марганца
Как видно из рис. 8, кривые практически совпадают. Это говорит о том, что основные продукты реакции обнаружены, и материальный баланс по компонентам сведен с достаточной точностью.
Влияние начальных концентраций реагентов и катализатора на окисление ПК
Влияние изменения начальных условий на окисление проводили по описанной выше методике. В качестве разбавителя реакционной массы инертным также использовали пара-дихлорбензол. Кинетические кривые приведены на рис. 9.
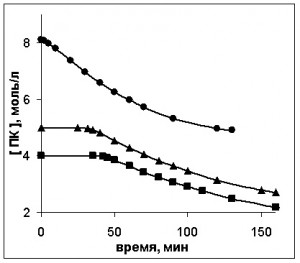 Рис. 9. Кинетические кривые окисления ПК при изменении его начальной концентрации, моль/л: ▲ – 8,11; ■ – 5; ● – 4.
Рис. 9. Кинетические кривые окисления ПК при изменении его начальной концентрации, моль/л: ▲ – 8,11; ■ – 5; ● – 4.
[MnSt2]0=0,0016 моль/л
Снижение начальной концентрации ПК так же увеличивает индукционный период и снижает скорость окисления, что отражается и на кривых изменения концентраций продуктов. Наиболее существенные отличия наблюдаются в виде кинетических кривых трехвалентной формы катализатора (рис. 10).
Рис. 10. Кинетические кривые изменения концентрации активной формы при изменении начальной концентрации ПК, моль/л: ■ – 4; ▲– 5; ● – 8,11. [MnSt2]0=0,0016 моль/л
Из рис. 10 видно, что концентрация трехвалентного марганца в течение индукционного периода доходит до максимального значения, равного начальной концентрации катализатора, а затем постепенно снижается, при этом цвет реакционной массы светлеет, переходя в соломенно-желтый.
Влияние концентрации катализатора на скорость окисления ПК
Увеличение концентрации катализатора приводит к возрастанию продолжительности индукционного периода и к увеличению начальной скорости окисления после его окончания. Концентрация трехвалентной формы марганца достигает максимального значения, равного начальной концентрации MnSt2, к моменту начала ускоренного расходования ПК.
Предположим, что начальная скорость окисления ПК зависит от концентраций Mn3+ и углеводорода по тому же закону, что и в случае кобальта. Эта зависимость приведена на рис. 11.
Рис. 11. Зависимость начальной скорости окисления ПК от начальных концентраций ПК и катализатора
Линейность этой функции подтверждает предположение о виде зависимости начальной скорости от концентрационных условий реакции:
где rПК0 – начальная скорость окисления ПК (моль/(л·мин));
[Mn3+]0 – концентрация трехвалентной формы кобальта в начальный момент развитого процесса окисления; (моль/л);
[ПК]0 – концентрация ПК в начальный момент развитого процесса окисления (моль/л);
k=0,0511 л1/2/(моль1/2·мин).
Расчет показывает, что марганец действительно более активен в отношении углеводорода, чем кобальт, однако он быстро теряет активность при окислении, необратимо переходя в двухвалентную форму.
Обсуждение результатов
Из полученных по окислению ПК с кобальтовым катализатором данных следует, что после окончания индукционного периода практически весь катализатор находится в высшей валентной форме. Эта форма, по-видимому, является каталитически активной, т.к. концентрация двухвалентного кобальта стремится к нулю в ходе развитого процесса. В случае марганцевого катализатора трехвалентный ион в присутствии других промежуточных продуктов окисления ПК неустойчив и в развитом процессе быстро и необратимо теряет активность. Тем не менее, скорость окисления углеводорода в его присутствии примерно в 4 раза выше, чем в присутствии кобальта. Таким образом, каждый из рассмотренных катализаторов обладает собственными достоинствами и недостатками. Кобальт устойчив в реакционной среде, достаточно активен как катализатор окисления углеводорода, но малопригоден для получения кислот из углеводородов вследствие большой продолжительности процесса. В отличие от него более активный марганец необратимо отравляется побочными продуктами процесса, что приводит к быстрому торможению окисления.
Очевидно, существует возможность сочетать достоинства обоих катализаторов и уменьшить их недостатки, применяя смешанные каталитические системы, в которых будут присутствовать оба металла. Кроме того, важную информацию о поведении катализаторов в ходе развитого процесса может дать исследование влияние продуктов реакции на ее скорость.
Библиографический список
- Н.Г. Дигуров, Т.В. Бухаркина, С.В. Вержичинская, М.Е. Макаров Жидкофазное окисление этилбензола кислородом воздуха в присутствии смешанного кобальтмарганцевого катализатора. Технологии нефти и газа (научно-технологический журнал), №3, 2010, с. 31-36.
- Овчинников В.И., Назимок В.Ф., Симонова Т.А. Производство терефталевой кислоты и ее диметилового эфира. М.: Химия, 1982. 282 с.