Введение
В результате промышленной и хозяйственной деятельности человека во внешнюю среду выбрасывается большое количество отходов, содержащих различные соединения тяжелых металлов, которые являются токсичными для растений, животных и человека. Загрязнение тяжелыми металлами атмосферы, почвы, воды является серьезной проблемой, потому что все больше культурных ландшафтов попадают под их воздействие, что в свою очередь сказывается как на продуктивности сельскохозяйственных культур, так и на качестве продуктов [2, 3].
В данный момент разработано большое количество методов очистки стоков, но высокая стоимость и сложность реализации процессов очистки ограничивают их практическое применение. Чаще всего токсичные стоки сбрасываются в водоемы после разбавления до уровня ПДК, тем не менее, такой «способ очистки» не препятствует к накоплению токсикантов в данной среде.
Множество веществ природного и искусственного происхождения обладают свойствами сорбентов, например, зола, торф, силикагели, алюмогели, активированные угли, глины, опилки и т.д. Известно, что сорбционными свойствами обладает и шерсть [1]. Сорбционные свойства шерсти определяются особенностями физического и химического строения волокон, а также применяемого сорбата. Более перспективным, учитывая товарное предназначение шерсти и ее высокую стоимость, видится использование для очистки сточных вод отходов, полученных на разных стадиях переработки шерстяного сырья. Повысить сорбционную емкость шерсти по отношению к ионам тяжелых металлов представляется возможным с помощью химической и физико-химической модификации.
Целью данной работы является исследование процесса сорбции ионов Cu(II) шерстяным волокном из водного раствора сульфата меди.
Экспериментальная часть. Кинетику сорбции ионов меди исследуют в статических условиях при перемешивании методом ограниченного объема раствора [4]. Для получения кинетических кривых в серию пробирок помещают навески сорбента массой по 0,10 г, заливают их 10 см3 водного раствора сульфата металла. Начальная концентрация ионов меди составляла 1,5·10-4 моль/л. Через определенные промежутки времени раствор отделяют от сорбента фильтрованием и определяют в нем текущую концентрацию ионов металлов (Сt) методом атомно-абсорбционной спектроскопии на приборах 210VGP и МГА-915МД.
Сорбционную емкость сорбента в каждый конкретный момент времени t рассчитывают по формуле (1):
где Сsorb.– сорбционная емкость, ммоль/г; С0 – начальная концентрация ионов металла, моль/л; С – концентрация ионов металла в момент времени , моль/л; m – масса навески сорбента, г; V – объем раствора, л.
Для исследования влияния концентрации металла в растворе на равновесие в ионообменной системе снимают изотермы сорбции. Для получения изотерм процесс сорбции проводят следующим образом: в серию пробирок помещают навески сорбента массой по 0,10 г и заливают их 10 мл водного раствора сульфата металла с концентрациями металла в интервале 1,510-4 – 510-2моль/л и выдерживают при перемешивании до установления состояния равновесия (время достижения сорбционного равновесия определяют при исследовании кинетики сорбции). Затем раствор отделяют от сорбента фильтрованием и определяют в нем равновесную концентрацию ионов металла (Се) методом атомно-абсорбционной спектроскопии. В условиях установившегося равновесия в системе определяют равновесную концентрацию ионов металла в растворе (Се) и рассчитывают равновесную сорбционную емкость:
где Сsorb.,e – равновесная сорбционная емкость, мг/г; Се – равновесная концентрация ионов металла, моль/л.
Степень извлечения a определяют следующим образом:
.gif) (3)
(3)Коэффициент распределения KD рассчитывают как отношение концентрации ионов металла в фазе полимера (Сsorb.) к его содержанию в растворе:
Результаты и их обсуждение. Для определения параметров, характеризующих сорбционные свойства шерстяного волокна, была получена кинетическая кривая сорбции ионов Cu(II). Результаты эксперимента на рисунке 1.
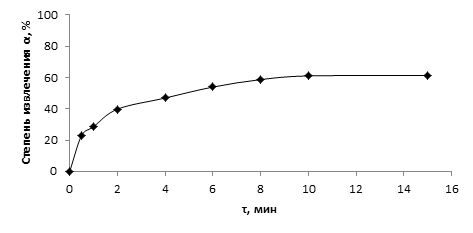
Согласно полученным данным шерстяное волокно сравнительно эффективно сорбирует ионы меди. Среднее время достижения сорбционного равновесия в гетерогенной системе водный раствор сульфата металла – сорбент составляет 10 мин.
Для определения предельной сорбционной емкости шерстяного волокна была получена изотерма сорбции ионов Cu(II) из водных растворов сульфатов. Результаты эксперимента представлены на рисунке 2.
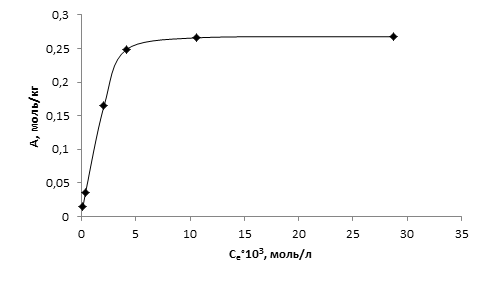
Полученные экспериментальные данные описаны уравнением изотермы адсорбции Ленгмюра:

где АR – предельная или максимальная сорбционная емкость полимера по данному металлу, моль/кг; К – концентрационная константа сорбционного равновесия, характеризующая интенсивность процесса сорбции, л/моль; Се – равновесная концентрация сорбата, моль/л [5].
Линеаризация изотермы сорбции по уравнению (5) позволяет графически определить в уравнении Ленгмюра величины А и К из опытных данных по распределению исследуемого сорбата в гетерофазной системе водный раствор – сорбент шерстяное волокно.
.gif)
Результаты обработки изотермы сорбции ионов меди шерстяным волокном по модели Ленгмюра представлены на рисунке 3 и в таблице 1.
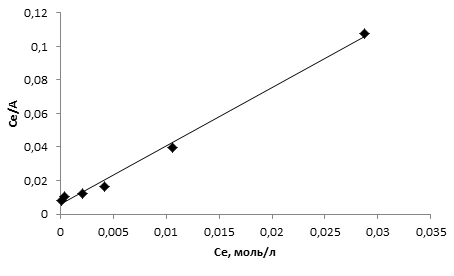
Таблица 1 – Параметры обработки изотермы сорбции по модели Ленгмюра методом наименьших квадратов
|
Катион металла
|
1/АК
|
1/А
|
Коэффициент корреляции
|
А, моль/кг
|
| Cu(II) | 0,006 ± 510-4 | 3,48 ± 0,04 | 0,99 | 0,29 |
Таким образом, как видно из рис. 3 в координатах Се/А – Се наблюдается линейная зависимость с коэффициентом корреляции (R) 0,99. Это говорит о том, что экспериментальные данные по сорбции ионов меди на волокнах шерсти хорошо аппроксимируются уравнением Ленгмюра, а из значений величин предельной сорбции (А8) (табл. 1,), полученных в ходе обработки изотерм сорбции с использованием этого уравнения следует, что данный сорбент обладает сравнительно невысокой связывающей способности по отношению к ионам меди.
Выводы. Исследованы сорбционные свойства сорбента – шерстяного волокна по отношению к ионам Cu(II).
Экспериментальная изотерма сорбции ионов меди обработана в рамках модели сорбции Ленгмюра. Показано, что данная модель позволяет достаточно хорошо, с коэффициентом корреляции 0,99, описать процесс сорбции в линейной форме уравнения. Установлено, что предельная сорбция А8, полученная с использованием модели Ленгмюра, согласуется с опытными данными.
Библиографический список
- Никифорова, Т.Е. Особенности сорбции ионов тяжелых металлов белковым сорбентом из водных сред / Т.Е. Никифорова, В.А. Козлов, М.В. Родионова // Журн. Прикл. Химии. – 2010. – Т. 83, Вып. 7. – С.1073-1078.
- Алексеев Ю.В. Тяжелые металлы в почвах и растениях. Л.: ВО Атомиздат, 1987. 365 с.
- Петров О.Ю., Александров Ю.А. Медико-биологические и нравственные аспекты полноценного питания. Учебное пособие. Йошкар-Ола: ГОУВПО «Марийский государственный университет», 2008. 223 с.
- Кокотков Ю.А., Пасечник В.А. Равновесие и кинетика ионного бомена. Л.: Химия, 1970. 336 с.
- Фролов Ю. Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы; 2-е изд., перераб. и доп. М.: Химия, 1989. 464 с.
