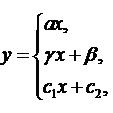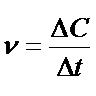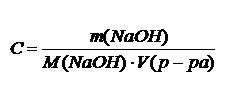Карбонаты слагают 18% осадочной оболочки земли и широко используются в самых разных отраслях народного хозяйства. Они играют важную роль в химизме океана и атмосферы, в геохимических и термодинамических процессах земли, метаморфизме и магматизме, а по последним исследованиям – и в возникновении жизни на Земле.
Карбонатными породами в широком смысле называют осадочные горные породы, состоящие в основном из кальцита СаСО3, доломита СаMg(СО3), магнезита MgСО3, сидерита FeCO3, анкерита СаСО3(Mg,Fe)СО3 и др. [1…3].
В настоящее время все более широкое распространение получают композиционные материалы, полученные на основе доломитов и доломитизированных известняков в присутствии щелочных активизаторов [4…6].
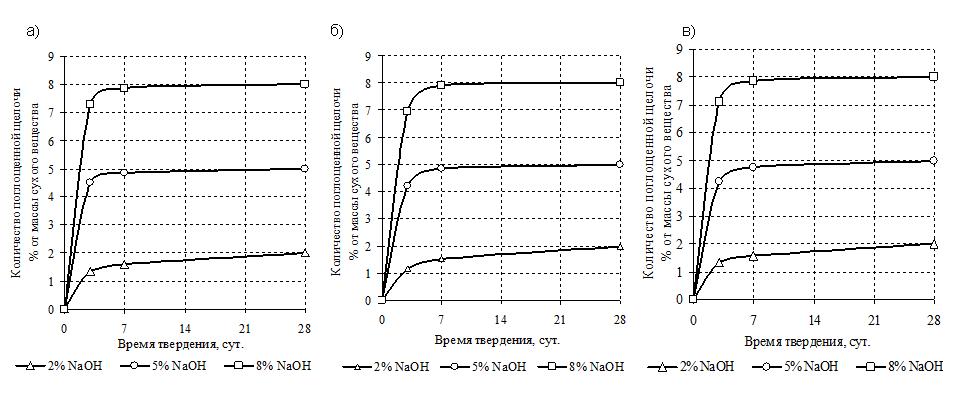
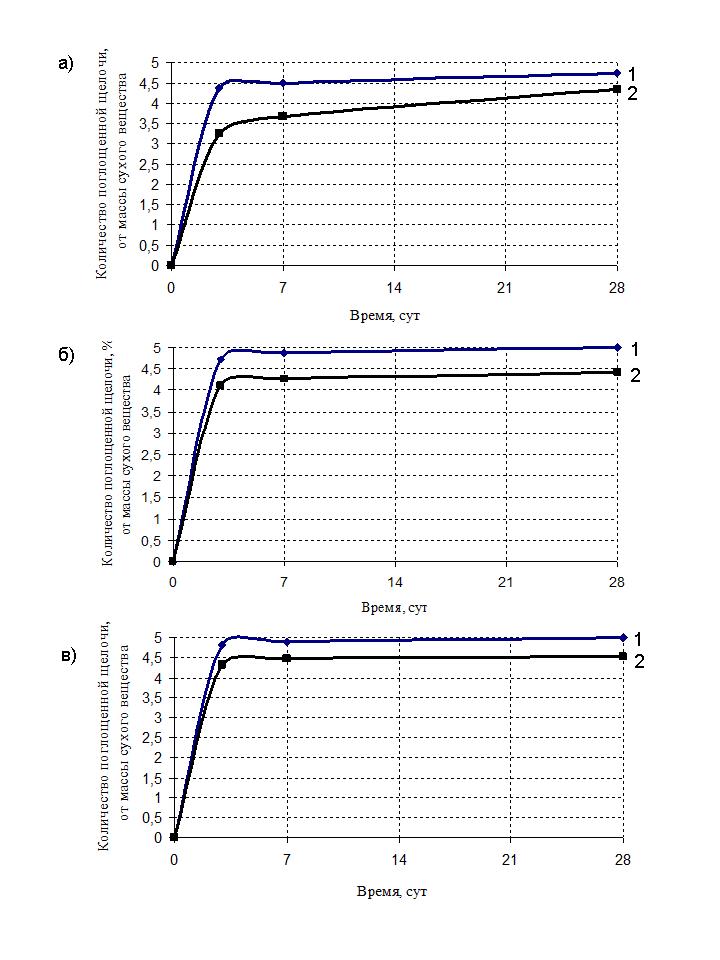
В условиях создания доломитощелочных вяжущих особый интерес представляет анализ кинетики поглощения щелочи в доломитах и доломитизированных известняках. На рис 1 приведена зависимость поглощения активизатора от количества исходной щелочи NаОН.
Рис.1 Кинетика поглощения NаОН в зависимости от количества исходной щелочи: а) доломитизированный известняк, б) доломит Воронежский, в) доломит (Сатка).
Максимальное поглощение щелочи (рис. 1), свидетельствующее о протекании реакционного процесса, наблюдается в ранние сроки твердения на 5-7 сутки, причем наибольшая скорость поглощения NаОН проявляется в доломитизированном известняке. Так, на третьи сутки твердения количество остаточной щелочи (табл. 1) при ее исходном содержании 2, 5 и 8% составляет в доломите Воронежском 0,18; 0,27 и 0,65%, в доломите (Сатка) 0,25; 0,27;0,65 %, а в доломитизированном известняке – 0,12; 0,17 и 0,52% от массы породы соответственно.
Во всех исследованных доломитощелочных системах полное потребление щелочи заканчивается в период между 7 и 28 сутками. Следует заметить, что в процесс поглощения NаОН протекает с определенной закономерностью: увеличение концентрации щелочного активизатора в доломитощелочной системе повышает степень усвоения ее карбонатной породой в ходе химического взаимодействия. Это можно проследить на примере доломитизированного известняка: при введении 2% активизатора в возрасте 3 суток количество поглощенной щелочи составляет 1,48%, а при введении 8% активизатора это количество составляет 7,88% от массы карбонатной породы.
Из характера кривых поглощения щелочи видно, что все они носят практически симбатный характер, смещаясь относительно друг друга с изменением дозировки щелочи. Попытка аналитического описания кинетических кривых привели к следующей системе уравнений:
0≤х≤3; 7≤х≤28; 3≤х≤7
где α, β, γ, с1, с2- коэффициенты;
х – время твердения.
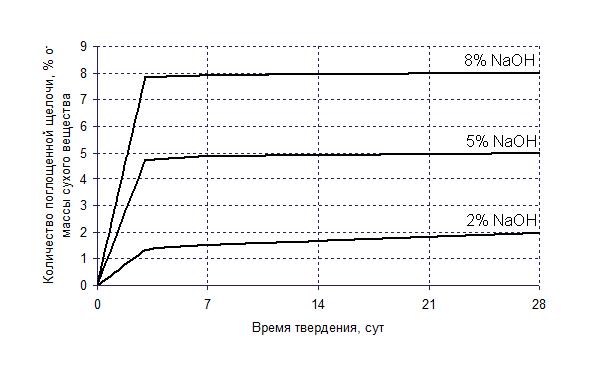
При дозировке щелочи 2, 5 и 8% рассчитанные значения коэффициентов находятся в пределах: α =0,45-0,49, 1,57-1,61 и 2,61-2,63; γ =0,019-0,023, 0,004-0,12, 0,003-0,007; β =1,36-1,47, 4,67-4,88, 7,80-7,90; с1 =0,14-0,28, 0,02-0,15, 0,04-0,11; с2 =0,04-1,32, 4,56-4,73, 7,70-7,82, соответственно. С учетом рассчитанных коэффициентов были построены аналитические кривые, которые приведены на рис. 2.
Рис. 2 Аналитические кривые поглощения щелочи на примере доломитизированного известняка.
Для определения кинетики реакционно-химического взаимодействия исследуемых карбонатных пород со щелочным активизатором были рассчитаны значения скоростей химической реакции в различные сроки твердения при 2, 5 и 8% исходного NаОН. Поскольку основным фактором, обусловливающим интенсивность протекания реакционно-химического взаимодействия в доломитощелочной системе, является скорость поглощения исходного щелочного реагента, то значения скоростей реакционного процесса определяли по следующей формуле [7]:
где ∆С – изменение концентрации раствора NаОН, моль/л;
∆t – изменение времени, сут.
Значения концентрации раствора NаОН находили по формуле:
где m – масса щелочи NаОН, г;
М – мольная масса NаОН, г/моль;
V – объем раствора NаОН, л.
Полученные по формулам данные приведены в табл. 1.
Таблица 1. Кинетика реакционно-химического взаимодействия карбонатных пород со щелочным активизатором NaOH в различные сроки твердения
|
Вид карбонатной породы |
Количество исходного NaOH, % от массы сухого вещества |
Концентрация раствора NaOH СМ после, моль/л |
Скорость химической реакции v в различные сроки твердения, моль/л·сут |
|||||
|
0 сут |
3 сут |
7 сут |
28 сут |
0-3 сут |
3-7 сут |
7-28 сут |
||
|
Доломитизированный известняк |
2 |
4,17 |
1,08 |
0,83 |
0 |
1,03 |
0,063 |
0,040 |
|
5 |
10,42 |
0,35 |
0,19 |
0 |
3,36 |
0,040 |
0,009 |
|
|
8 |
16,67 |
0,25 |
0,15 |
0 |
5,47 |
0,025 |
0,007 |
|
|
Доломит Воронежский |
2 |
4,17 |
1,35 |
1,00 |
0 |
0,94 |
0,090 |
0,048 |
|
5 |
10,42 |
0,56 |
0,29 |
0 |
3,29 |
0,070 |
0,014 |
|
|
8 |
16,67 |
0,38 |
0,19 |
0 |
5,43 |
0,050 |
0,009 |
|
|
Доломит (Сатка) |
2 |
4,17 |
1,35 |
0,85 |
0 |
0,94 |
0,125 |
0,040 |
|
5 |
10,42 |
0,56 |
0,52 |
0 |
3,29 |
0,010 |
0,025 |
|
|
8 |
16,67 |
0,38 |
0,31 |
0 |
5,43 |
0,018 |
0,015 |
|
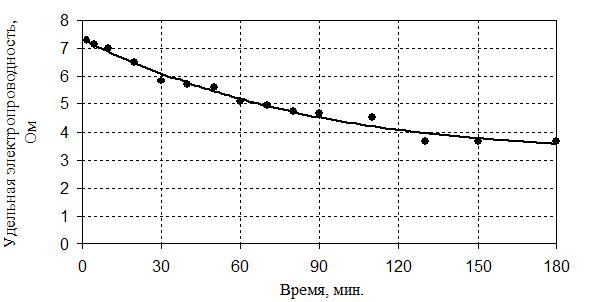
Рис. 3 Изменение удельной электропроводности в начальные сроки твердения.
Карбонат MgСО3 и гидроксид магния Mg(ОН)2, будучи нерастворимыми соединениями, а также постоянная концентрация ионов Na+ вносят незначительный вклад в изменение электропроводности раствора, поэтому электропроводность определяется подвижностью ионов ОН- и СО32-.
Исходные соединения реагируют в эквивалентных количествах, значит, нормальная концентрация эквивалента NаОН и Na2CO3 будет одинакова. При концентрации СN = 0,1 моль-экв/л эквивалентная концентрация l(ОН-) = 157×104 Ом-1×моль-экв-1×м2, l(СО32-) = 38×10-4 Ом-1×моль-экв-1×м2. Удельная электропроводность связана с эквивалентной соотношением l= æ×1000/C (где С – концентрация ионов электролита, моль/л), поэтому при взаимодействии карбонатной породы со щелочью наблюдается уменьшение удельной электропроводности.
В ранние сроки твердения в результате интенсивного реакционно-химического взаимодействия карбонатной породы со щелочным компонентом происходит ионообменная реакция, о чем свидетельствует быстрое уменьшение удельной электропроводности в течение 1,5 ч. Суперколлоидные частицы продуктов реакции уменьшают диффузионную проницаемость барьерного слоя, что приводит к замедлению скорости реакционного процесса в поздние сроки. В дальнейший период твердения в результате начала кристаллизации продуктов реакции, иногда включающей молекулы воды, и уменьшения концентрации ионов в растворе изменение удельной электропроводности в доломитощелочной смеси незначительно.
На рис. 4 и в табл. 2 представлена кинетика поглощения щелочи в зависимости от вида активизатора в различные сроки твердения. Результаты показывают, что интенсивное поглощение щелочного активизатора (рис. 4), свидетельствующее о наибольшей скорости протекания реакционного процесса, наблюдается при введении гидроксида натрия NaOH. Так, при введении в качестве активизатора NaOH остаточное содержание его на третьи сутки твердения в магнезите составляет 0,63%, в доломите 0,27%, в доломитизированном известняке 0,17%, а при введении КОН остаточное содержание составляет в магнезите 1,74%, в доломите 0,88%, в доломитизированном известняке 0,68%.
Таблица 2. Cодержание (Na,К)2СО3, (Na,К)ОН и Mg(OH)2 в карбонатной породе при введении различных щелочных активизаторов
|
Вид карбонатной породы |
Количество активизатора, % от массы сухого вещества |
Вид активизатора |
Содержание (Na,К)2СО3, (Na,К)ОН и Mg(OH)2, % от массы сухого вещества |
||||||||
|
3 сут |
7 сут |
28 сут |
|||||||||
|
(Na,К)ОН |
(Na,К)2СО3 |
Mg(OH)2 |
(Na,К)ОН |
(Na,К)2СО3 |
Mg(OH)2 |
(Na,К)ОН |
(Na,К)2СО3 |
Mg(OH)2 |
|||
|
Магнезит |
5 |
NaОН |
0,63 |
0,85 |
0,74 |
0,50 |
1,28 |
0,70 |
0,25 |
2,06 |
0,46 |
|
5 |
КОН |
1,74 |
0,65 |
0,69 |
1,33 |
0,93 |
0,66 |
0,66 |
1,18 |
0,42 |
|
|
Доломит Воронежский |
5 |
NaОН |
0,27 |
2,90 |
0,39 |
0,14 |
3,80 |
0,51 |
0 |
5,37 |
0,77 |
|
5 |
КОН |
0,88 |
2,05 |
0,34 |
0,74 |
2,85 |
0,47 |
0,59 |
4,21 |
0,63 |
|
|
Доломитизированный известняк |
5 |
NaОН |
0,17 |
3,20 |
0,28 |
0,09 |
4,45 |
0,37 |
0 |
5,53 |
0,46 |
|
5 |
КОН |
0,68 |
3,00 |
0,25 |
0,53 |
3,81 |
0,34 |
0,47 |
3,86 |
0,42 |
|
Рис.4 Кинетика поглощения щелочи в зависимости от вида вводимого активизатора (1 – NаОН; 2 – КОН);а) магнезит, б) доломит воронежский, в) доломитизированный известняк.
Необходимо отметить, что максимальный расход активизатора происходит в реакции с доломитизированном известняком, содержащим меньшее количество MgCO3. Так, в начальные сроки твердения количество поглощенной щелочи магнезите составляет 3,26-4,37%, в доломите 4,12-4,33%, в доломитизированном известняке 4,32-4,83% в зависимости от вида активизатора. В поздние сроки в доломите и доломитизированном известняке NaOH полностью расходуется, в то время как при использовании в качестве щелочного компонента КОН в системах на основе всех исследуемых карбонатных пород часть щелочи остается непрореагировавшей. Таким образом, наиболее интенсивное поглощение щелочи наблюдается при использовании в качестве щелочного активизатора NaОН. В химических процессах, протекающих в доломитощелочных системах, КОН отличается пониженной реакционно-химической активностью по сравнению с NaOH, хотя полнота прохождения реакции должна достигать более высоких значений, т.к. концентрация КОН в пересчете на моль вещества меньше. Объяснить данный факт, по всей вероятности, можно, рассмотрев механизм протекания химической реакции в карбонатнощелочной системе.
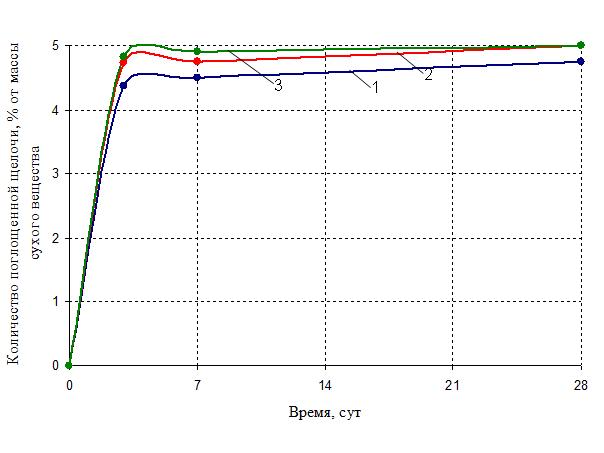
В случае использования в качестве активизатора КОН первая стадия реакции, протекающей по гетерогенному механизму, проходит интенсивно вследствие большей подвижности ионов калия К+, однако, ионы калия обладают и повышенной адсорбционной способностью, в результате чего образующийся в ходе реакции карбонат калия К2СО3 остается в приповерхностной зоне реакции. В связи с этим новые порции реагента не поступают к поверхности, о чем свидетельствует довольно значительное количество остаточной щелочи КОН в доломитощелочных системах, и выделение К2СО3 и Mg(OH)2 уменьшается. На рис. 5 приведена кинетика поглощения NaOH в различных карбонатных породах.
Полученные результаты показывают, что наиболее интенсивное поглощение щелочи, свидетельствующее о наивысшей скорости реакционного процесса, наблюдается в системе на основе доломитизированного известняка, т.е. карбонатной породы с наименьшим содержанием реакционно-активного MgCO3.
Рис. 5 Кинетика поглощения активизатора в зависимости от вида карбонатной породы при 5% исходного NaOH: 1 – магнезит, 2 – доломит, 3 – доломитизированный известняк.
Так, на третьи сутки твердения количество остаточной щелочи (табл. 3) составляет в магнезите 0,63%, в доломите 0,27%, а в доломитизированном известняке лишь 0,17% от массы сухого вещества. На седьмые сутки это количество равно в магнезите 0,50%, доломите 0,25%, а в доломитизированном известняке 0,17% от массы сухого вещества. По достижении 28-суточного возраста в доломите и доломитизированном известняке щелочь расходуется, в то время как в магнезите количество остаточного NaOH составляет 0,25% от массы сухого вещества.
Таблица 3. Cодержание Na2СО3, NaОН и Mg(OH)2 в различных карбонатных породах
|
Вид карбонатной породы |
Содержание MgCO3 в карбонатной породе, % |
Количество NaOH, % от массы сухого вещества |
Содержание Na2СО3, NaОН и Mg(OH)2 в материале, % от массы сухого вещества |
||||||||
|
3 сут |
7 сут |
28 сут |
|||||||||
|
NaОН |
Na2СО3 |
Mg(OH)2 |
NaОН |
Na2СО3 |
Mg(OH)2 |
NaОН |
Na2СО3 |
Mg(OH)2 |
|||
|
Магнезит |
98,0 |
5 |
0,63 |
0,85 |
0,74 |
0,50 |
1,28 |
0,70 |
0,25 |
2,06 |
0,46 |
|
Доломит (Сатка) |
39,0 |
5 |
0,27 |
2,60 |
0,61 |
0,25 |
3,40 |
1,00 |
0,0 |
5,37 |
1,35 |
|
Доломитизированный известняк |
12,6 |
5 |
0,17 |
3,20 |
0,28 |
0,09 |
4,45 |
0,37 |
0,0 |
4,30 |
0,77 |
Таким образом, на основании полученных данных можно сделать вывод, что вид карбонатной породы оказывает влияние на кинетику поглощения щелочи: наиболее интенсивное поглощение NaOH наблюдается в карбонатной породе с наименьшим содержанием реакционно-активного MgCO3.
Библиографический список
- Виноградов, С.С. Известняки [Текст] / С.С. Виноградов.– М.: Госгеолиздат, 1951.
- Фидер, Р.Дж. Карбонаты «Минералогия и химия» (пер. с англ.) [Текст] / Под ред. Р. Дж. Фидера. – М. Мир, 1987, 496с.
- Глуховский, В.Д. Шлакощелочные бетоны на мелкозернистых заполнителях [Текст] / В.Д. Глуховский, Н.В.Кривенко, В.Н. Старчу, И.А.Пашков, В.В. Чиркова. – Киев: Вища школа, 1981. – 224 с.
- Шумкина, А.А. Модифицированные доломитошлаковые вяжущие и строительные материалы на их основе / А.А. Шумкина: автореферат диссертации на соискание ученой степени кандидата технических наук. – ПГАСА, 2005. – 21 с.
- Шумкина, А.А. Модифицированные доломитошлаковые вяжущие и строительные материалы на их основе / А.А. Шумкина: канд. диссертация. – ПГАСА, 2005.-171 с.
- Шумкина, А.А. Исследование реакционной активности доломитизированных карбонатных пород в щелочных средах [Текст] / А.А. Шумкина, М.Н. Карев // Современные проблемы науки и образования.- 2014.- № 2. – С.134.
- Некрасов, Б.Д.. Курс общей химии. [Текст] / Б.Д. Некрасов. – М., Госхимиздат, 1964.
- Каушанский, В.Е.Возможности активации жидкой фазы в процессе гидратации вяжущих материалов / Каушанский В.Е., Тихомиров И.М. // Тезисы докладов и сообщений IV Всесоюзного совещания по гидратации и твердению цемента. – Львов, 1981. – с.37-43.
- Ребиндер, П.А. Поверхностные явления в дисперсных системах. Коллоидная химия: Избранные труды [Текст] / П.А. Ребиндер – Наука, 1978. – 368с.
- Ляликов, Ю.С. Физико-химические методы анализа [Текст] / Ю.С. Ляликов. – М., Химия, 1964.