В настоящее время все большей популярностью пользуется фитотерапия – лечение лекарственными средствами растительного происхождения.
Одним из перспективных растений является лабазник вязолистный (Filipendula ulmaria L.), семейства розоцветные (Rosaceae) (лабазник).
Лабазник широко применяется как в официнальной, так и в народной медицине. Цветки лабазника разрешены к применению в качестве гемостатического и диуретического средства, экстракт травы лабазника имеет широкий спектр фармакологической активности, включая противодиабетическое, антиоксидантное, противовоспалительное, жаропонижающее, противомикробное и ноотропное действие [1, 2, 3, 4, 6, 8].
Одной из групп биологически активных веществ, обнаруженных в лабазнике, являются флавоноиды, которые обладают ангиопротекторным, гепатопротекторным, желчегонным, диуретическим, нейротропным, антимикробным и ноотропным свойствами [4, 5]. Это позволяет прийти к заключению о том, что флавоноиды являются одной из основных групп биологически активных веществ лабазника. Из этой группы биологически активных веществ в траве лабазника идентифицированы кверцетин, изокверцетин, рутин, авикулярин, а также флавоноид, который ранее не идентифицировался в других растениях – филимарин (4′-О–D-галактопиранозид кверцетина) [1]. В соответствии с литературными сведениями, содержание суммы флавонодиов в траве растения колеблется от 2,8 до 5,6% в различных регионах России – таких как Красноярский и Алтайский края, Кемеровская, Свердловская и Томская области [1, 3, 9].
На территории Архангельской области лабазник распространен повсеместно, что делает возможным осуществление заготовки растительного сырья (РС). В настоящее время литературные сведения о содержании биологически активных веществ в лабазнике, произрастающем на территории Архангельской области, отсутствуют, поэтому актуальным является нормирование качества исследуемого вида РС.
Целью работы являлось определение содержания основной группы БАВ – флавоноидов, в траве лабазника, заготовленного на территории Архангельской области и сравнение полученных результатов с приводимыми литературе сведениями.
В качестве объекта исследования использовали воздушно высушенную траву лабазника, заготовленную на территории Няндомского района Архангельской области в июле 2015 года. Заготовка сырья производилась в фазу цветения растения.
В ходе предварительных исследований проводили стандартизацию изучаемого вида РС по числовым показателям, в том числе было определено значение потери в массе при высушивании, которое составило 10,11%.
Для определения суммы флавоноидов применяли реакцию комплексообразования с раствором алюминия хлорида исключая вклад в значение оптической плотности других групп соединений в пересчете на рутин [7]. С этой целью точную навеску сырья (около 0,5 г) измельченного до размера частиц, проходящих сквозь сито с отверстиями диаметром 1 мм, помещали в колбу со шлифом вместимостью 50 мл, добавляли 25 мл спирта этилового (спирт) 70%, нагревали на водяной бане с обратным холодильником в течении 1 часа. После охлаждения полученное извлечение декантировали в мерную колбу вместимостью 50 мл. Процесс экстрагирования повторяли. Объединенные извлечения доводили до метки спиртом (раствор А)
2 мл раствора А помещали в мерную колбу вместимостью 25 мл, добавляли 50 мкл раствора кислоты уксусной (ГОСТ 61-75) разведенной, 2 мл спиртового раствора алюминия хлорида 5% и доводили объем раствора до метки спиртом.
Оптическую плотность определяли через 40 мин на спектрофотометре СФ-56А в кварцевых кюветах с толщиной слоя 1 см. В качестве раствора сравнения использовали раствор, приготовленный аналогично исследуемому, но без добавления 5% раствора алюминия хлорида [7].
Максимум оптической плотности дифференциального спектра исследуемого раствора совпадал максимумом оптической плотности дифференциального спектра рутина и находился в области 410 ± 2 нм, поэтому рутин был выбран нами в качестве стандартного образца.
Параллельно в тех же условиях измеряли оптическую плотность раствора, содержащего 1 мл 0,05% рабочего стандартного образца (РСО) рутина («Sigma–Aldrich», Italy, 207671–50–9), приготовленного аналогично исследуемому раствору [7]. Образец получаемых электронных спектров представлен на рис. 1.

Рис. 1 Электронные спектры исследуемых растворов
1 – электронный спектр спиртового извлечения из воздушно–сухой травы лабазника вязолистного; 2 – электронный спектр 0,05% раствора СО рутина
Содержание суммы флавоноидов в воздушно–сухой траве лабазника, в пересчете на рутин (X, %) и абсолютно сухое сырье рассчитывали по формуле:
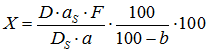 , где
, гдеD – оптическая плотность исследуемого раствора
DS – оптическая плотность раствора СО рутина
a – масса сырья (г)
aS – масса СО рутина (г)
F – фактор разведения
b – потеря в массе при высушивании
Результаты количественного определения суммы флавоноидов в воздушно–сухом сырье лабазника в пересчете на рутин и абсолютно сухое сырье представлены в табл. 1.
|
Масса сырья, г
|
Оптическая плотность исследуемого раствора
|
Навеска СО рутина, г
|
Оптическая плотность раствора СО рутина
|
Рассчитанное количество флавоноидов, %
|
Метрологические характеристики
|
|
0,47010
|
0,4894
|
0,05
|
0,9283
|
3,12
|
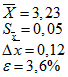 |
|
0,49595
|
0,5453
|
0,05
|
0,9283
|
3,29
|
|
|
0,47030
|
0,4826
|
0,05
|
0,9283
|
3,07
|
|
|
0,46090
|
0,5152
|
0,05
|
0,9283
|
3,35
|
|
|
0,48120
|
0,5300
|
0,05
|
0,9283
|
3,30
|
|
|
0,50325
|
0,5456
|
0,05
|
0,9283
|
3,25
|
Таким образом, в результате проведенных исследований было установлено, что содержание суммы флавоноидов в воздушно–сухом сырье лабазника, произрастающего на территории Архангельской области, превышает 3%. Это значение находится в интервале содержания данной группы БАВ (2,8 – 5,6%) в РС других регионов России.
Библиографический список
- Авдеева, Е.Ю. Исследование лабазника вязолистного как источника эффективного ноотропного средства: автореф. дис. … канд. фарм. наук / Е. Ю. Авдеева – Пермь, 2008. – 27 с.
- Барнаулов, О. Д. Противодиабетические свойства настоя цветков лабазника вязолистного / О. Д. Барнаулов, М. Л. Поспелова // Психофармакология и биологическая наркология. – 2005. – №4. – С. 1113-1120.
- Величко, Н. А. Лабазник вязолистный (Filipendula ulmaria) как ингридиент цветочного чая / Н. А. Величко // Вестник КрасГАУ. – 2014. – №1. – С. 158-160.
- Ковалева, Л.Г. Современное состояние и перспективы дальнейшего исследования плодов софоры японской / Л. Г. Ковалева, А.М. Сампиев, М.Р. Хочава, Е.Б. Никифорова // Науч. Ведом., Сер. Медицина, Фармация. – 2012. – № 22. – Т. 141. – вып. 20. – С. 163 – 170.
- Куркин, В. А. Флавоноиды как биологически активные соединения лекарственных растений / В. А. Куркин, А. В. Куркина, Е. В. Авдеева // Фундаментальные исследования. – 2013. – №11. – С. 1897-1901.
- Поспелова, М.Л. Антиоксидантная активность флавоноидов из цветков лабазника вязолистного Filipendula ulmaria (L.) Maxim. / М.Л. Поспелова, О.Д. Барнаулов, Е.В. Туманов // Психофармакология и биологическая наркология. – 2005. – № 1. – С. 841–843.
- Струсовская, О. Г. Ресурсоведческие и фитохимические исследования перспективных видов сырья дикорастущих растений островов Соловецкого архипелага : дисс. … докт. фарм. наук / О. Г. Струсовская – Волгоград, 2014. – C. 145-150.
- Committee on Herbal Medicinal Products. Assessment report on Filipendula ulmaria (L.) Maxim.herba and Filipendula ulmaria (L.) Maxim. flos / HMPC. – 2011. – 18 p.
- Vysochina, G. I. Biologically Active Substances in Filipendula ulmaria (L.) Maxim. Growing in the Middle Urals / G. I. Vysochina, T. A. Kukushkina and E. S. Vasfilov // Chemistry for Sustainable Development. – 2013. – №21. – P. 369–374.
