Введение
В растениях одной из наиболее распространенных групп биологически активных веществ (БАВ) являются дубильные вещества (танины), которые обладают широким спектром фармакологической активности. Дубильные вещества оказывают кровоостанавливающее, вяжущее, противовоспалительное, антимикробное действие, а также проявляют высокую P-витаминную активность, антисклеротическое и антигипоксическое действие. Конденсированные дубильные вещества являются антиоксидантами, оказывают противоопухолевый эффект. Танины используют как противоядие при отравлении гликозидами, алкалоидами, солями тяжелых металлов. В медицине дубильные вещества применяются в терапии таких заболеваний как стоматиты, гингивиты, фарингиты, ангины, колиты, энтероколиты, дизентерии, применяют их и при ожогах, маточных, желудочных и геморроидальных кровотечениях [1].
Определение содержания дубильных веществ является важным составляющим в установлении качества растительного сырья, содержащего танины. Для определения дубильных веществ существует различные методы, но чаще всего применяются титриметрический и спектрофотометрический методы [2].
Цель работы – валидационная оценка методик количественного определения дубильных веществ по показателям сходимость, правильность, линейность.
Материалы и методы исследования
В качестве объекта исследования использовалось сырье – воздушно-сухая трава манжетки обыкновенной (Alchemilla vulgaris L.)сем. Розоцветные (Rosaceae).
Для валидационной оценки методик количественного определения дубильных веществ в воздушно-сухой траве манжетки обыкновенной были выбраны два метода: перманганатометрическое титрование [3] и спектрофотометрическое определение на основе реакции с реактивом Фолина-Чокальтеу [4]. Выбор методик обоснован частотой использования их на практике.
Воздушно-сухую траву манжетки обыкновенной заготавливали в сентябре 2015 года в Приморском районе Архангельской области, которая являлась сырьем для исследования и количественного определения дубильных веществ (танинов).
Методика перманганатометрического определения является фармакопейной, которая и основана на реакции окисления танинов раствором калия перманганата [3]. Около 2 г (точная навеска), измельченного сырья, просеянного сквозь сито с размером отверстий 3 мм, помещали в коническую колбу вместимостью 500 мл, прибавляли 250 мл нагретой до кипения воды и кипятили с обратным холодильником на электрической плитке с закрытой спиралью в течение 30 минут при периодическом перемешивании. Полученное извлечение охлаждали до комнатной температуры и процеживали коническую колбу вместимостью 250 мл через вату так, чтобы частицы сырья не попали в колбу. Отбирали пипеткой 25 мл полученного извлечения и переносили в другую коническую колбу вместимостью 750 мл, прибавили 500 мл воды, 25 мл раствора индигосульфокислоты и титровали при постоянном перемешивании раствором калия перманганата (0,02 моль/л) до золотисто-желтого окрашивания.
Параллельно проводили контрольный опыт.
1 мл раствора перманганата калия (0,02 моль/л) соответствует 0,004157 г дубильных веществ в пересчете на танин.
Содержание дубильных веществ (Х), в процентах, в пересчете на абсолютное сухое сырье, вычислили по формуле (1):
V – объем раствора перманганата калия (0,02 моль/л), израсходованного на титрование извлечения, мл;
![]() – объем раствора перманганата калия (0,02 моль/л), израсходованного на титрование в контрольном опыте, мл;
– объем раствора перманганата калия (0,02 моль/л), израсходованного на титрование в контрольном опыте, мл;
0,004157 – количество дубильных веществ, соответствующее 1 мл раствора перманганата калия (0,02 моль/л) (в пересчете на танин), г;
250 – общий объем извлечения, мл;
25 – объем извлечения, взятого для титрования, мл.
m – масса сырья, г;
W – потеря в массе при высушивании сырья, г;
Для количественного определения дубильных веществ методом спектрофотометрии, около 1 г (точная навеска) исследуемого растительного сырья, измельченного до размера частиц, проходящих через сита с размером отверстий 1 мм, помещали в коническую колбу со шлифом вместимостью 50 мл, добавляли 25 мл смеси ацетон-вода в соотношении 7:3 (70% раствор ацетона). Колбу закрывали и помещали в лабораторное перемешивающее устройство (ЛАБ ПУ-2, Россия) на 60 минут. Полученное извлечение фильтровали в мерную колбу вместимостью 50 мл и доводили объем до метки 70% раствором ацетона (раствор А).
В мерную колбу вместимостью 10 мл помещали 1 мл раствора А, объем раствора в колбе доводили водой очищенной до метки (раствор Б).
0,5 мл раствора Б помещали в мерную колбу вместимостью 10 мл, добавляли 2 мл воды очищенной, 0,25 мл реактива Фолена-Чокальтеу, 1,25 мл 20% раствора натрия карбоната и доводили объем раствора водой до метки. Колбу оставляли на 40 минут в защищенном от света месте. Оптическую плотность раствора определяли при длине волны 750 нм. В качестве раствора сравнения использовали смесь реактивов без добавления извлечения.
Содержание дубильных веществ в извлечениях из растительного сырья рассчитывали по значениям градуировочного графика для построения которого, использовали 0,1 мг/мл раствор стандартного образца CO танина. С этой целью 0,05 г (точная масса) CO танина помещали в мерную колбу вместимостью 100 мл, растворяли в 30 мл воды и объем в колбе доводили тем же растворителем до метки (раствор A).
1 мл полученного раствора переносили в мерную колбу вместимостью 10 мл. Объем раствора в колбе доводили водой до метки (раствор Б).
Серию растворов, содержащих по 1; 2; 3; 4; 5 мкг/мл CO танина готовили, помещая навески раствора Б в мерные колбы вместимостью 10 мл, прибавляли реактив Фолина–Чокалтеу и 20% водный раствор натрия карбоната, объем растворов в колбе доводили водой до метки.
Растворы перемешивали, колбы укупоривали и выдерживали при комнатной температуре в защищенном от света месте в течение 40 мин.
Оптическую плотность полученных растворов определяли спектрофотометрически в кварцевых кюветах с толщиной слоя 1 см при длине волны 725 нм относительно раствора сравнения.
Раствор сравнения представлял собой смесь реагентов без добавления CO танина (раствор B).
По результатам проведенных исследований строили график зависимости оптической плотности от концентрации танина (рис.1).
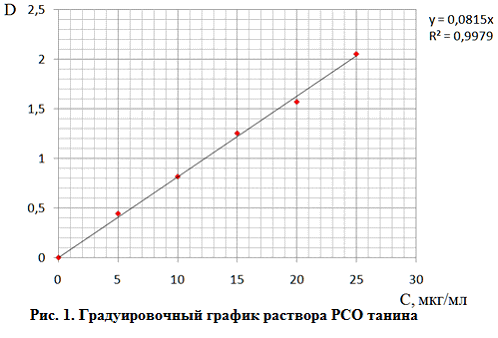 С учетом полученных значений рассчитывали сумму дубильных веществ, в пересчете на танин по формуле:
С учетом полученных значений рассчитывали сумму дубильных веществ, в пересчете на танин по формуле:
с – содержание дубильных веществ, найденное по градуировочному графику, мкг/мл;
F – фактор разведения;
а – навеска сырья, г;
b – потеря в массе при высушивании (%).
Результаты
Результаты количественного определения дубильных веществ методом титрования представлены в табл. 1.
| Масса навески растительного сырья, г | Объём перманганата калия (0,02 моль/л), израсходованного на титрование полученного извлечения из растительного сырья, мл | Количество дубильных веществ, % (Xi) | Метрологические характеристики |
|
2,10250
|
7,4
|
15,34892
|
Δ ε = 2,52% Sr = 0,024 |
|
2,03255
|
7,4
|
15,21262
|
|
|
2,18345
|
8,2
|
15,84713
|
|
|
2,24350
|
8,6
|
16,24333
|
|
|
2,12465
|
8,0
|
15,85257
|
|
|
2,07055
|
7,6
|
15,80574
|
Среднее значение содержания дубильных веществ в сырье составило 15,7%. Рассчитанное значение величины относительного стандартного отклонения (0,024%), которое не превышает 2%, что характеризует удовлетворительную сходимость полученных результатов.
Для определения правильности методики использовали метод добавки. С этой целью в колбу для титрования добавляли по 1 мл 0,05%, 0,1% и 0,15% CO танина и титровали трижды для каждого случая. Результаты проведенных исследований представлены в табл. 2.
| Количество добавленного СО танина, г | Масса сырья, г | Рассчитанноеколичество дубильных веществ, г | Найденное количество дубильных веществ, г | Открываемость, % | Метрологические характеристики |
|
0,0005
|
2,2435
|
0,0357
|
0,0353
|
98,87
|
tрасч.=0,23 tтабл.=2,31 |
|
2,1247
|
0,0339
|
0,0340
|
100,29
|
||
|
2,0706
|
0,0330
|
0,0337
|
102,12
|
||
|
0,001
|
2,2435
|
0,0362
|
0,0357
|
98,61
|
|
|
2,1247
|
0,0344
|
0,0340
|
98,84
|
||
|
2,0706
|
0,0335
|
0,0336
|
100,51
|
||
|
0,0015
|
2,2435
|
0,0367
|
0,0366
|
99,73
|
|
|
2,1247
|
0,0349
|
0,0353
|
101,14
|
||
|
2,0706
|
0,0340
|
0,0337
|
99,12
|
Полученные результаты свидетельствуют о том, что рассчитанный коэффициент Стьюдента меньше табличного значения и методика не содержит систематической ошибки, что позволяет сделать вывод о ее правильности.
Для изучения линейности определяли зависимость найденных значений количественного содержания дубильных веществ от навески исследуемого растительного сырья. С этой целью проводили количественное определение танинов в шести навесках воздушно–сухого сырья манжетки обыкновенной, отличающихся по массе (табл. 3).
|
Навеска сырья, г |
Объем калия перманганата, пошедший на титрование, мл
|
Содержание дубильных веществ в навеске, г
|
|
2,0706
|
7,6
|
0,3159
|
|
3,0013
|
10,8
|
0,4490
|
|
4,0595
|
13,0
|
0,5404
|
|
5,1180
|
15,3
|
0,6360
|
|
6,1385
|
18,2
|
0,7566
|
По полученным в ходе проведенных исследований данным строили график зависимости определенного содержания дубильных веществ от массы навески исследуемого растительного сырья (рис. 2) и рассчитывали коэффициент корреляции.
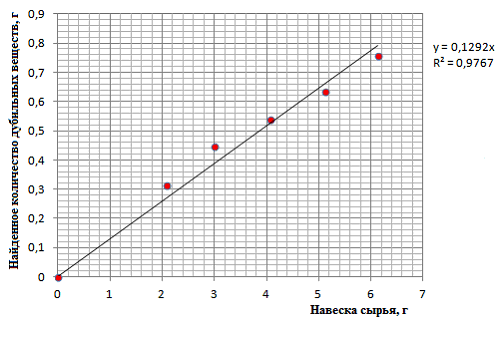
Рис. 2. График зависимости найденного количества дубильных веществ от массы навески воздушно сухого сырья манжетки обыкновенной
Рассчитанный коэффициент корелляции не превышал 0,95, что свидетельствует о линейности результатов определения содержания исследуемых веществ от массы навески анализируемого растительного сырья в обозначенном интервале концентраций.
Результаты количественного определения дубильных веществ в воздушно сухом сырье травы манжетки обыкновенной методом спектрофотометрии представлены в табл. 4.
Таблица 4. Результаты количественного определения дубильных веществ методом спектрофотометрии
|
Масса навески, г
|
Оптическая плотность раствора
|
Содержание дубильных веществ по градуировочному графику мкг/мл
|
Найденное количество дубильных веществ, % (Xi)
|
Метрологические характеристики
|
|
1,02755
|
0,5957
|
7,30920
|
7,87340
|
Δ ε = 3,61% Sr =0,034% |
|
0,99745
|
0,6130
|
7,52147
|
8,34656
|
|
|
1,0068
|
0,5678
|
6,96687
|
7,65932
|
|
|
0,99580
|
0,5742
|
7,04539
|
7,83120
|
|
|
1,0060
|
0,5750
|
7,05521
|
7,76261
|
|
|
1,00670
|
0,5617
|
6,89202
|
7,57779
|
Среднее значение содержания дубильных веществ в растительном сырье составляет 7,8% при относительном стандартном отклонении (0,034%), не превышающем 2%, что характеризует удовлетворительную сходимость результатов.
Для определения правильности методики использовали метод добавки. С этой целью в колбу с первичным ацетоновым извлечением добавляли по 1 мл 0,05%, 0,1% и 0,15% раствора CO танина и далее проводили количественное определение дубильных веществ трижды для каждой концентрации. Результаты проведенных исследований представлены в табл. 5.
|
Количество добавленного СО танина, г
|
Масса сырья, г
|
Рассчитанное количество дубильных веществ, г
|
Найденное количество дубильных веществ, г
|
Открываемость, %
|
Метрологические характеристики
|
| 0,0005 |
1,0068
|
0,0794
|
0,0803
|
101,13
|
tрасч.=0,13 tтабл.=2,31 |
|
1,0060
|
0,0794
|
0,0790
|
99,50
|
||
|
1,0276
|
0,0811
|
0,0804
|
99,14
|
||
|
0,001
|
1,00680
|
0,0799
|
0,0798
|
99,87
|
|
|
1,00600
|
0,0799
|
0,0807
|
101,00
|
||
|
1,02755
|
0,0816
|
0,0823
|
100,85
|
||
|
0,0015
|
1,00680
|
0,0804
|
0,0808
|
100,50
|
|
|
1,00600
|
0,0804
|
0,0792
|
98,51
|
||
|
1,02755
|
0,0821
|
0,0814
|
99,15
|
Полученные результаты свидетельствуют о том, что рассчитанный коэффициент Стьюдента меньше табличного значения и методика не содержит систематической ошибки, что позволяет сделать вывод о ее правильности.
Линейность методики оценили при построении градуировочного графика. Коэффициент корреляции R при этом не превышал 0,95, что говорит о линейности методики.
Выводы
В ходе проведенных исследований было установлено, что предложенные методики обладают удовлетворительной сходимостью, правильностью и линейностью.
Библиографический список
- О дубильных веществах [Электронный ресурс] / О продуктах питания: ингредиенты, пищевые добавки. – Режим доступа : http://x-prod.ru/veschestva/313-about-tannins.html
- Михайлова, Е.В. Методы количественного определения дубильных веществ в растительном сырье / Е.В. Михайлова, А.П. Васильева, Д.М. Мартынова // Актуальные вопросы современной медицины: материалы международной заочной научно-практической конференции. – Новосибирск: Изд. «СибАК», 2013. — 176 с.
- Определение содержания дубильных веществ в лекарственном растительном сырье и лекарственных растительных препаратах. ОФС.1.5.3.0008.15
- Струсовская О.Г. Ресурсоведческие и фитохимические исследования перспективных видов сырья дикорастущих растений островов Соловецкого архипелага : дисс. … д–ра фарм. наук / О.Г. Струсовская. – Волгоградский гос. мед. ун-т. Пятигорск, 2014.– 314 с.
