Актуальность
Проблема постоянного нарастания концентрации азотсодержащих ксенобиотиков в окружающей среде и их влияние на организм человека по-прежнему является актуальной проблемой медицины и экологии [1, 3]. Интенсивное применение в хозяйственной деятельности человека азотсодержащих химических соединений привело к возникновению экологической проблемы, связанной с избыточным поступлением данных веществ в организм человека и животных через воздух, воду, продукты питания и лекарства. Наиболее широкое распространение получили нитриты и нитраты, которые в процессе биотрансформации становятся источниками NO и других активных форм азота [1, 7]. Обладая сходными с кислородом химическими свойствами, они вступают в конкурентные отношения за места связывания О2, вызывая в организме гемическую (анемическую) гипоксию за счет снижения кислородной емкости крови и нарушения клеточного дыхания [5, 8]. Гипоксия приводит к расстройству функций органов и тканей, нарушению пластических и энергетических процессов в организме, патоморфологическим изменениям различных тканей.
В современных условиях общая нагрузка содержащими азот веществами, поступающими в организм человека в составе пищи, воды и вдыхаемого воздуха, может значительно превышать физиологические пределы [1, 5].
Целью проведения исследования явилось изучение морфометрических параметров миокарда самцов крыс в процессе развития гипоксии, индуцированной нитритом натрия NaNO2, т.к. именно мужская часть населения в силу профессиональной специфики наиболее часто подвержена контакту с нитросоединениями.
Материал и методы исследования
В работе использовали 5-ти месячных белых беспородных крыс-самцов массой 190-210 г. Эксперимент произведен на 15 животных, которые разбивались на две группы. Первую контрольную группу составили 7 самцов, содержащихся в стандартных условияx вивария. Вторую опытную группу составили 8 самцов, которым в течении 1 месяца ежедневно внутрибрюшинно вводили нитрит натрия NaNO2 в дозе 5 мг/100 г массы (доза, вызывающая гипоксию средней тяжести) [4].
Животные выводились из эксперимента путем декапитации под наркозом (эфир с хлороформом) в соответствии с требованиями правил проведения работ с использованием экспериментальных животных [2].
После проведения торако- и перикардиотомии под эфирным наркозом сердце извлекалось и сразу же помещалось в кардиоплегический раствор (0,9% КСl при температуре 00С), чем достигалась остановка сердца в диастолу.
Для гистологических исследований образцы тканей левого желудочка сердца фиксировали в 10% формалине и после соответствующей проводки изготавливали парафиновые блоки. Гистологические срезы изготавливались толщиной 10-15 мкм, окрашивались гематоксилин-эозином, по Гомори и исследовались с помощью микроскопа Olympus CX-31 (Япония). Морфометрические измерения производили при увеличении 400х с помощью лицензионной программы Image J [6]. Статистическая обработка полученных данных проводилась с помощью лицензионной программы Microsoft Excel 2007. Проводилась окраска срезов миокарда ГОФП-методом (гематоксилин-основной фуксин-пикриновая кислота) с целью выявления очагов ишемического повреждения.
Ультратонкие срезы изготавливали на ультратомеУМТП-7 (Украина), красили толуидиновым синим, контрастировали цитратом свинца и уранилацетатом.
Результаты исследования и их обсуждение
Гистологическое и морфометрическое изучение миокарда самцов опытной группы выявило наличие признаков общетоксического действия нитрита натрия.
При окраске гематоксилин-эозином в экспериментальной группе по сравнению с контролем отмечалось достоверное уменьшение длины и площади кардиомиоцитов соответственно на 18,38% и 35,21% (р≤0,05), что свидетельствовало об их ишемических и гипоксических повреждениях.
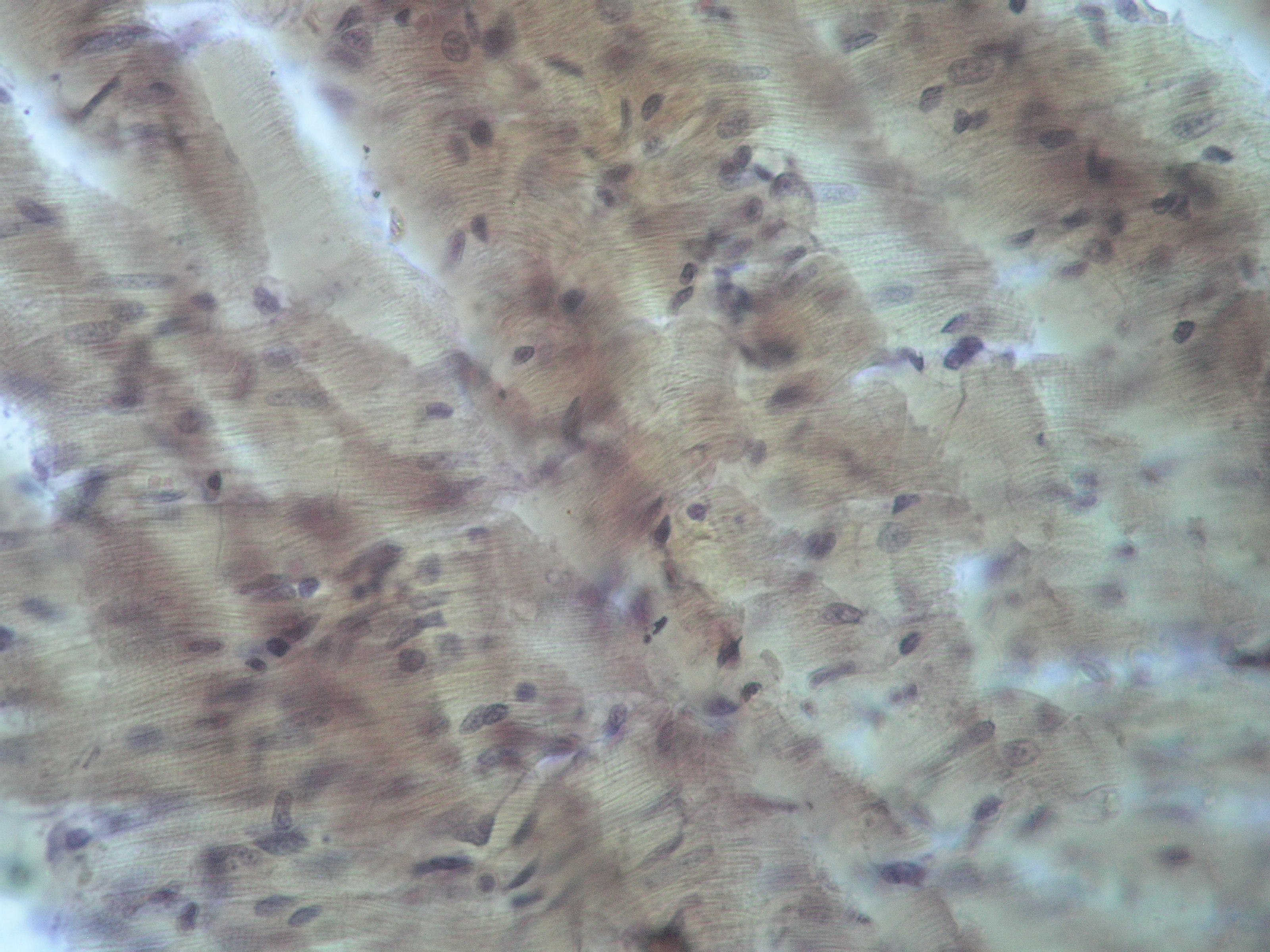
При оценке структуры кардиомиоцитов у животных экспериментальной группы выявлено, что контуры сократительных кардиомиоцитов были нечеткими, их цитоплазма неравномерно окрашена, зернистая, что свидетельствует о развитии смешанной дистрофии. Поперечная исчерченность миофибрилл была нечетко выражена, местами отсутствовала, между мышечными волокнами обнаруживались участки круглоклеточной инфильтрации (рис. 1). Выявлялись многочисленные ригорные комплексы, которые являлись следствием повреждения митохондрий и избыточного поступления ионов кальция Ca2+ в саркоплазму через расширенные мембранные поры. Ядра кардиомиоцитов отличались полиморфизмом формы (округлые, вытянутые) за счет отека саркоплазмы и имели очаги просветления за счет неравномерной конденсации хроматина (рис. 2).
Рис. 1. Полиморфизм ядер кардиомиоцитов, явления смешанной дистрофии, контрактурные изменения, лизис и разволокнение миофибрилл, “рваные красные волокна” – маркер необратимого повреждения митохондрий. Окраска: Гомори. Ув. х 1000.
При этом диаметр ядер кардиомиоцитов и их площадь за счет отека незначительно увеличивались по сравнению с контролем на 5,31 % и 7,76% соответственно. Ядерно-цитоплазматический индекс в опытной группе вырос на 42,85 % (р ≤ 0,05) , по сравнению с контролем,. Выявленная морфологическая картина свидетельствует об ишемическом поражении миокарда левого желудочка и гипоксии правого, а также подтверждает развитие межмиофибриллярного отека. Ишемические и гипоксические изменения миокарда носят «мозаичный» характер, что проявляется неравномерным увеличением ядер кардиомиоцитов
Рис. 2. Явления межмышечного отека. Полутонкий срез. Окраска: толуидиновым синим. Ув. х 1000.
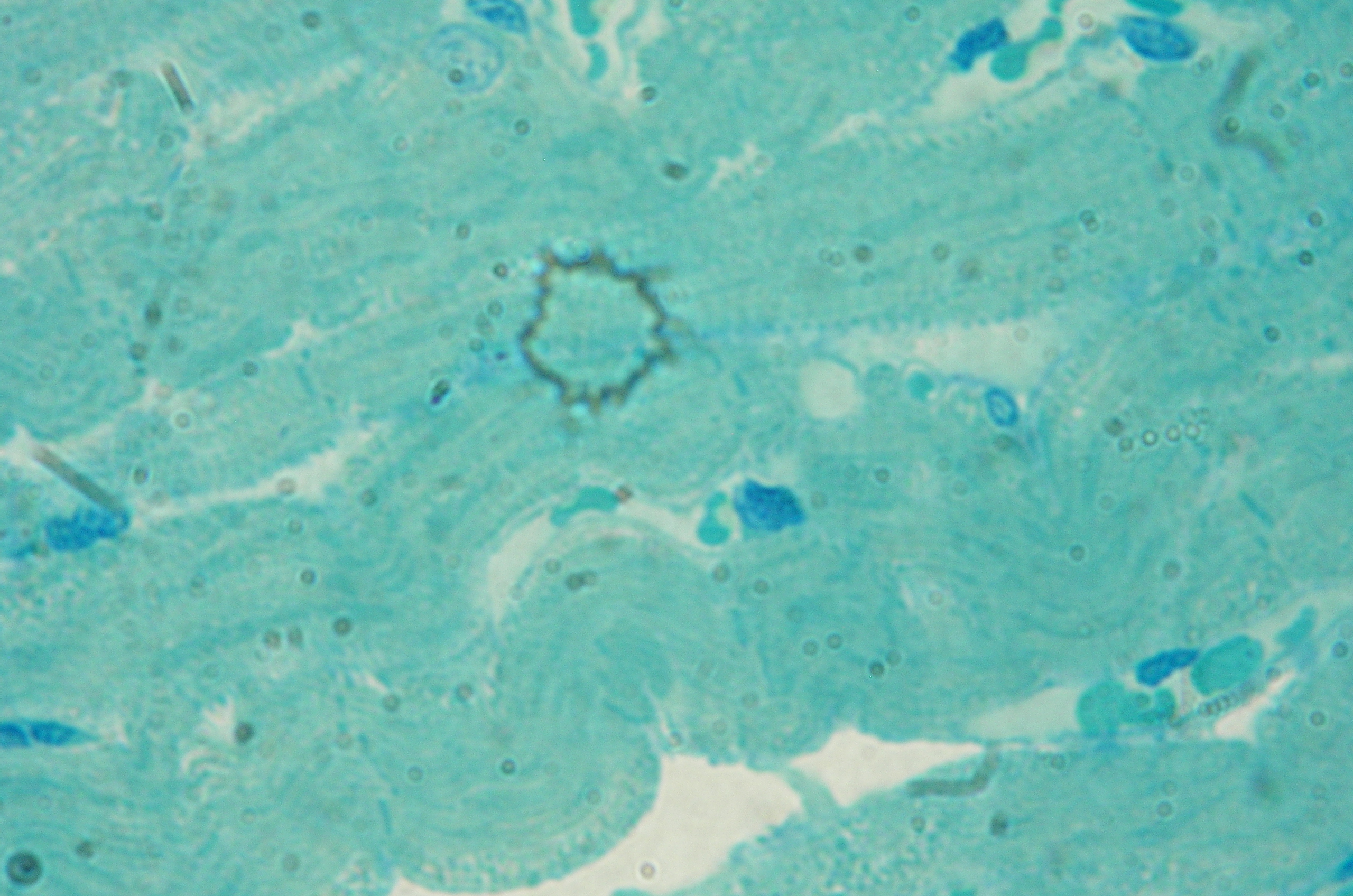
В условиях гемической гипоксии, которая сопровождалась избыточной концентрацией ионов NO, наблюдалось расширение просветов сосудов микроциркуляторного русла и разрастание соединительной ткани в стенке сосудов и между миофибриллами (рис.3). Морфометрически это проявлялось увеличением, по сравнению с контролем, диаметра артериол на 9,87% (р≤ 0,05), диаметра просвета артериол – на 23,61% (р≤0,05), общей площади артериол – на 2,19% (р≤ 0,05), что свидетельствует о значительном расширении просвета артериол и отеке эндотелиоцитов. Стромально-кардиомиоцитарные отношения, по сравнению с контролем, за счет отека и коллагеногенеза выросли на 35,63% (р ≤ 0,05).
Рис. 3. Перикапиллярный отек. Лимфоцитарная инфильтрация. Большое количество диффузно расположенных мелких очагов умеренно выраженной фуксинофилии интерстиция. Окраска: ГОФП-метод. Ув. х 400.
Таким образом, влияние хронической гемической гипоксии на миокард, изученное нами также в предыдущих работах [8], проявляется морфофункциональными сдвигами различной степени выраженности, отражающими глубокие тканевые изменения, проявляющиеся в переходе из компенсаторно-приспособительных процессов в необратимые деструктивные изменения. Это способствует нарушениям процессов микроциркуляции, а также стимулирует коллагеногенеза в интерстиции миокарда, что приводит к прогрессирующему снижению объёма кардиомиоцитов, их дегенерации и атрофии. Таким образом, хроническая гемическая гипоксия способствует прогрессированию миокардиальной дисфункции.
Выводы:
1. Хроническое поступление азотсодержащих ксенобиотиков в организм оказывает выраженное токсическое действие на миокард самцов крыс, которое проявляется в виде ишемических и гипоксических повреждений сократительных кардиомиоцитов и эндотелиоцитов, с последующей их гибелью.
2. Основные морфологические признаки нитритного повреждения миокарда представлены в виде явлений смешанной дистрофии и отека сократительных кардиомиоцитов, лизиса миофибрилл, развития ригорных комплексов, расширения просветов артериол и увеличения содержания коллагена в интерстиции.
3. Выявленные признаки структурной перестройки миокарда являются предикторами миокардиальной дисфункции, что обуславливает необходимость проведения кардиопротекции.
Библиографический список
- Ажипа Я.И., Реутов В.П., Каюшин Л.П. Экологические и медико-биологические аспекты проблемы загрязнения окружающей среды нитратами и нитритами // Физиология человека. 1990. №16. С. 131-150.
- Международные рекомендации по проведению медико-биологических исследований с использованием животных. Основные принципы // Ланималогия.1993. № 1. С. 29.
- Середенко М.М. Механизмы развития и компенсация гемической гипоксии. Киев: “Наукова думка”. 1987. 178 с.
- Черкесова Д.У., Омаров М.-С.А. Экспериментальная модель внутриутробной нитритной гипоксии // Бюллетень. «Медицина. Наука и практика». ДНЦРАМН. 1995. №1. С. 44-46.
- Baskin S.I., Horowitz A.M., Nealley E.W. The antidotal action of sodium nitrite and sodium thiosulfate against cyanide poisoning. The Journal of Clinical Pharmacology. 1992. № 32. Р 368-375.
- Collins, T.J. ImageJ for microscopy. BioTechniques. 2007. № 43. Р. 25–30.
- Knekt P., Järvinen R., Dich J., Hakulinen T. Risk of colorectal and other gastro-intestinal cancers after exposure to nitrate, nitrite and N-nitrosocompounds: a follow-up stud. Int. J. Cancer. 2001; № 80. Р. 852–856.
- Zadnipryany I.V., Sataieva T.P. Neonatal rat myocardium survival in terms of chronic hemic hypoxia // In the world of Scientific discoveries. 2014. №10(58). С. 281-290.