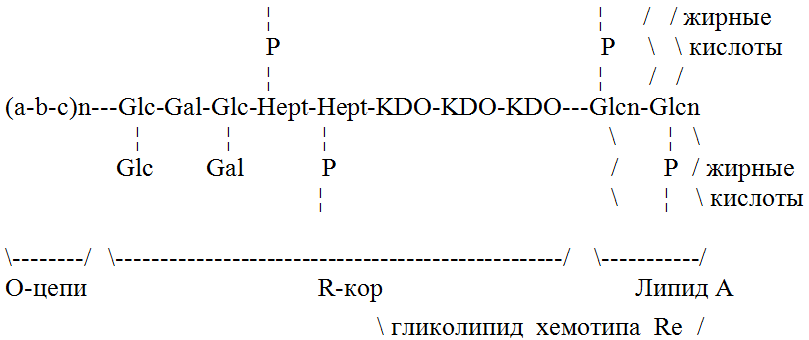
Эндотоксин (ЭТ) представляет собой липополисахарид (ЛПС), являющийся облигатным компонентом наружной мембраны всех грамотрицательных бактерий. Эндотоксин освобождается в просвет кишечника в результате самообновления клеточного пула сапрофитной микрофлоры и/или насильственного разрушения в результате антибактериальной терапии, пищевых отравлений, дисбактериозов, кишечных токсикоинфекций и др. Одна из моделей структуры ЭТ, а именно ЛПС Salmonella typhimurium, предложенная O. Westphal, представлена на схеме (рис.1) [1, P.1].
Субъединица ЛПС состоит из трех крупных частей: О-цепь, R-кор и липид А. Наружная часть ЛПС – О-цепь – построена из повторяющихся олигосахаридных звеньев, которые состоят из 3-4 сахаров. Эта часть ЛПС определяет специфичность О-антигена бактерий и значительно варьирует у разных видов грамотрицательных бактерий.
Средняя область – R-кор представляет собой олигосахарид, структура которого менее вариабельна, чем структура О-цепи. Наиболее постоянными составляющими R-кор являются сахара, примыкающие к липидной части ЛПС.
Липид А представляет собой консервативную химическую структуру и обуславливает общность биологических свойств ЛПС всех грамотрицательных бактерий. В естественных условиях синтеза эндотоксина липид А существует в комплексе с тремя молекулами кетодезоксиоктулоновой кислоты. Этот комплекс входит в состав биохимической структуры всех ЛПС. Изолированно он синтезируется в генетически дефектных штаммах грамотрицательных микроорганизмов, так называемых Re-мутантах, и носит название Re-гликолипида. Именно с этим ферментом ЛПС связан практически весь спектр биологической активности эндотоксина.
Рис.1. Схема строения ЛПС грамотрицательных бактерий
Эндотоксин обладает целым рядом биологических свойств. Перечень видов биологической активности эндотоксина:
- активация лейкоцитов и макрофагов;
- стимуляция продукции эндогенного пирогена, антагониста
глюкокортикоидов, интерферона, интерлейкинов,
туморнекротизирующего фактора (кахексина) и других медиаторов;
- активация синтеза белков острой фазы, в том числе амилоидного
белка;
- митогенный эффект;
- активация миелопоеза;
- поликлональная активация В-клеток;
- индукция развития провирусов;
- подавление тканевого дыхания;
- развитие гиперлипидемии;
- активация системы комплемента;
- активация тромбоцитов и факторов свертывания крови;
- гибель клеток;
- местный и генерализованный феномен Шварцмана;
- диссеминированное внутрисосудистое свертывание крови (ДВС);
- эндотоксиновый шок и развитие острой полиорганной
недостаточности [2, c. 8-13].
Большой интерес исследователей к ЛПС обусловлен не только его уникальной структурой и широкой по разнообразию вызываемых эффектов биологической активностью, но и тем обстоятельством, что человек находится в постоянном контакте с ЭТ, так как в кишечнике обитает довольно большое количество Гр- бактерий. До недавнего времени считалось, что неповрежденная слизистая толстой кишки здорового человека является достаточно надежным барьером, предотвращающим попадание ЛПС в кровоток в больших количествах. В эксперименте чистый ЭТ через кишечный эпителий не проникал [3, P.43-48]. В связи с этим, общепринятым являлось мнение о том, что ЛПС из кишечника в нормальных условиях в кровоток не проникает или проникает в незначительных количествах лишь в систему воротной вены, но не в системный кровоток. Однако в последние годы эта точка зрения существенно меняется. Исследования, проведенные под руководством М. Ю. Яковлева в лаборатории патологической анатомии экстремальных состояний Института морфологии человека АМН СССР, впервые установили факт присутствия кишечного ЛПС в общем кровотоке практически здоровых людей [4, c. 127-128; 5]. Последующие исследования показали, что ЭТ проникает в общий кровоток новорожденного уже в первые часы жизни, и этот процесс синхронен с заселением кишечника младенца грамотрицательной микрофлорой [6, c. 67-68]. Более того, получены данные, свидетельствующие о том, что ЛПС может проникать в кровь плода уже внутриутробно [7, c. 131-137].
Процесс проникновения ЭТ в кровоток усиливается при повреждениях слизистой кишечника, при дисбактериозах и различных воздействиях, которые сопровождаются транслокацией бактерий и продуктов их жизнедеятельности из кишечника в другие органы и ткани [2, c. 8-13; 8, c. 87-91].
ЛПС может взаимодействовать практически со всеми клетками макроорганизма. На поверхности клеток млекопитающих имеются специфичные для ЭТ белковые рецепторы CD 14, CD 18, Toll-рецепторы и другие [9, P. 439-441]. Функции этих рецепторов различны. При связывании с рецепторным белком CD18 эндотоксин не вызывает активацию полиморфноядерных лейкоцитов (ПЯЛ). В то же время, при связывании с LBP-белком (lipopolysaccharid binding protein) плазмы крови ЛПС, в комплексе с этим белком, реагирует с рецептором CD14 на поверхности клетки, что приводит к активации лейкоцитов [10, P. 2193]. Связывание эндотоксина c Toll-рецептором приводит к активации врожденного иммунитета.
В значительной мере биологическая активность ЛПС обусловлена его взаимодействием с лейкоцитами, макрофагами, эндотелиальными клетками и др. [5]. Основным акцептирующим ЭТ клеточным элементом крови человека являются полиморфноядерные лейкоциты (ПЯЛ) [4, c. 127-128; 5]. Известно несколько видов взаимодействия ЛПС с лейкоцитами. Взаимодействие гидрофобных структур ЛПС с мембранными компонентами клеток может зависеть от появления под действием ЭТ и содержания на поверхности нейтрофилов эндотелиально-лейкоцитарных адгезивных молекул (ELAM) [11, P. 94]. В частности к ELAM относят селектины. Е-селектин (ELAM-1) присутствует на плазматической мембране нейтрофилов и других фагоцитов. L-селектин (VCAM-1-сосудистая адгезивная молекула) находится на моноцитах и лимфоцитах и не обнаруживается на гранулярных лейкоцитах. Лигандом для адгезивной молекулы VCAM-1 являются медленно реагирующие антигены – VLA (a4, b4), которые также находятся на лимфоцитах и моноцитах. ПЯЛ на действие ЛПС отвечают освобождением цитокинов, интерлейкина-1b (IL-Ib) и фактора некроза опухоли (TNF-a), увеличением синтеза VCAM-1. VCAM-1 участвует в адгезии различных типов лимфоцитов, включая связывание B-клеток. Адгезию негранулярных лейкоцитов обеспечивают мембранные иммуноглобулины (ICAM-1, ICAM-2), связывающиеся с лимфоцитассоциированным антигеном- LFA-1. Подобно Е-селектину и VCAM-1, ICAM-1 вырабатывается на агранулоцитах только после их стимуляции IL-1 и TNF-a в ответ на воздействие ЭТ. В опытах на крысах Lewis было отмечено индуцированное повреждение эндотелия эндотоксином через экспрессию ICAM-1 при обработке IL-2, TNF-a и IFN-g. Усиление воздействия ICAM-1 заключается в адгезии лейкоцитов, среди которых преобладают моноциты (около 80%) и Т-лимфоциты (от 8% до 20%). Максимальная адгезия лейкоцитов отмечается к 6 часам с момента воздействия ЭТ и продолжается до 72 часов. Затем моноциты и лимфоциты активно проникают в сосудистую стенку через межклеточные каналы даже неповрежденных эндотелиальных клеток [12, P. 241].
Следующей особенностью взаимодействия ЭТ с лейкоцитами является Fc-зависимое связывание ЛПС антителами, локализованными на Fc-рецепторах лейкоцитов [13, c. 76-79]. Этот вид взаимодействия приводит к фагоцитозу и инактивации ЭТ.
После введения кроликам ЭТ в дозе 0,25 мг ЛПС обнаруживается через 1-1,5 часа на 40% циркулирующих ПЯЛ. При этом они не разрушаются, как это было принято считать ранее, а перераспределяются в маргинальный пул микроциркуляторного русла.
ЭТ может быть обнаружен на поверхности гранулоцитов в крови практически здоровых взрослых людей, новорожденных и их матерей [2, c. 8-13; 7, c. 131-137; 5]. Применение иммуноферментного анализа (ИФА) позволило показать, что в тонких мазках крови здоровых людей обнаруживается около 3-4% ПЯЛ, связавших ЛПС в кровотоке. Кроме того, еще около 5% ПЯЛ способны связывать ЭТ in vitro при обработке мазков препаратом ЛПС, т.е. у здоровых людей имеются резервы связывания эндотоксина гранулоцитами [5; 8, c. 87-91; 13, c. 76-79].
Библиографический список
- Westphal O. Bacterial Endotoxins // Int.Arch.Allergy Appl.Immunol. 1975. V.49.
- Лиходед В.Г., Ющук Н.Д., Яковлев М.Ю. Роль эндотоксина грамотрицательных бактерий в инфекционной и неинфекционной патологии // Архив патологии. 1996. №2.
- AU-Benoit R., Rowe S., Boyle P., Garret M. Alber S., Wiener J., Rowe M.I. Pure endfotoxin does not pass across the intestinal epithelium in vitro // Shock. 1998. V.10.
- Яковлев М.Ю. Роль кишечной микрофлоры и недостаточность барьерной функции печени в развитии эндотоксинемии и воспаления // Казан. мед. жур. 1988. №5.
- Яковлев М.Ю. Системная эндотоксинемия в физиологии и патологии человека. // Автореф. дисс. … д-ра мед. наук. М., 1993.
- Лиходед В.Г., Чхаидзе И.Г., Галдавадзе М.А. и др. Развитие кишечного дисбактериоза у новорожденных при дефиците антител к Re-гликолипиду // Микробиология. 1998. №4.
- Таболин В.А., Бельчик Ю.Ф., Чабаидзе Ж.Л. и др. Показатели антиэндотоксинового иммунитета у новорожденных в норме и патологии // Международн. журн. иммунореабил. 2000. № 1.
- Аниховская И.А., Опарина О.Н., Яковлева М.М., Яковлев М.Ю. Кишечный эндотоксин как универсальный фактор адаптации и патогенеза общего адаптационного синдрома // Физиология человека. 2006. Т.32. №2.
- Heumann D. CD14 and LPB in endotoxinemia and infections caused by Gram-negative bacteria // J. Endotox. Res. 2001. V. (6).
- Pugin J., Ulevitch R.J., Tobias P.S. A critical role for monocytes and CD14 in endotoxin-induced endothelial cell activation // J. Exp. Med. 1998. V.178.
- Amberger A., Maczek C., Jurgens G., Michaelis D. et al. Co-expression of ICAM-1, VCAM-1, ELAM-1 and Hsp60 in human arterial and venous endothelial cells in response to cytokines and oxidized low-density lipoproteins // Cell. Stress. Chaperones. 1997. V. 2(2).
- Seitz C.S., Kleindienst R., Xu Q., Wick G. Coexpression of heat-shock protein 60 and intercellular-adhesion molecule-1 is related to increased adhesion of monocytes and T cells to aortic endothelium of rats in response to endotoxin // Lab. Invest. 1996. V. 74(1).
- Лиходед В.Г., Аниховская И.В., Аполлонин А.В. и др. Fc-зависимое связывание эндотоксинов грамотрицательных бактерий полиморфноядерными лейкоцитами крови человека // Микробиология. 1996. №2.