Введение
Попадание ионов тяжелых металлов в питьевую воду и продукты питания непосредственно связано с состоянием окружающей среды. Загрязнение биосферы тяжелыми металлами стало одной из глобальных проблем, обусловленных их поступлением в окружающую среду, как с промышленными сточными водами, так и рассеиванием с газовыми выбросами. Рассеянные металлы способны концентрироваться в растениях, водоемах, почве, а затем с продуктами питания, питьевой водой и воздухом поступать в организм человека.
Одним из наиболее распространенных методов очистки является сорбционный. В большинстве случаев наилучших результатов достигают, применяя синтетические сорбенты, например, ионообменные смолы – иониты, которым свойственны высокие сорбционные свойства и возможность повторного использования. Однако, основным недостатком данных сорбентов является достаточно высокая стоимость, обусловленная многостадийностью процессов их получения. Кроме того, при их промышленном синтезе в качестве исходных соединений используют токсичные вещества (бензол, фенолы и др.), а источником ионообменных сорбентов является невозобновляемое органическое сырье [1].
В настоящее время для очистки сточных вод от ионов Pb(II), Cd(II), Hg(II), Cu(II), Ni(II), Cr(III) и Cr(VI) применяют самые разнообразные сельскохозяйственные отходы: скорлупу грецкого ореха и арахиса, шелуху зеленого миндаля, чайные листья, отходы производства оливкового масла, джутовое волокно, стебли подсолнечника, листья табака, а также опилки клена, дуба, ели. Так же можно использовать отходы, образующиеся при переработке различных фруктов и овощей: кожуру бананов, апельсинов и лимонов, морковный и яблочный жмых, выжимки из томатов, жом сахарной свеклы [2].
Перспективными биосорбентами являются древесина папайи, измельченные листья тикового дерева и кориандра, отходы саго, рисовая шелуха, древовидный папоротник, виноградные лозы, барда (отход пивоварения), выжимки сахарного тростника и т.д. [3].
Такой распространенный отход текстильной промышленности, как шерстяное волокно также может выступать в качестве основы для производства сорбентов. Наличие различных свойств обеспечивает высокую сорбционную способность шерсти, которые реализуются через основное белковое вещество шерсти – кератин [4].
Кератин – сложное полимерное белковое соединение, отличительной особенностью является наличие серы в белке [S].
Элементарный состав кератина характеризуется наличием пяти элементов [5]:
- углерода – до 50%
- кислорода – 21-24%
- азота – 16-18%
- водорода – 6-7%
- серы – 2-5%
Структуру кератина представлена на рисунке 1.
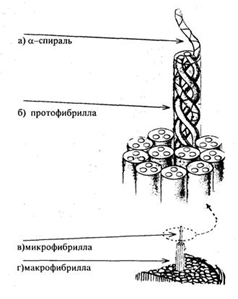
Рисунок 1 – Структура кератина шерсти
Молекула кератина имеет α-спираль (а), далее три полипептидные цепи, свитые жгутом (б), создают протофибриллу. 11 протофибрилл (9 по окружности и 2 в центре) образуют микрофибриллу (в). Микрофибриллы соединяются между собой матриксом (аморфным веществом) в макрофибриллу (г). Полипептидные цепи соединяются между собой дисульфидными мостиками.
Макромолекула кератина содержит аминогруппы – NН₂ и карбоксильные группы – СООН, что обусловливает его амфотерные свойства: в щелочной среде шерсть проявляет кислотные свойства, а в кислых растворах – щелочные свойства.
Амфотерные свойства аминокислот позволяют им взаимодействовать между собой с образованием пептидных связей щелочной и кислотными группами с выделением воды (рисунок 2). В результате образуются крупные молекулы с полипептидными связями.
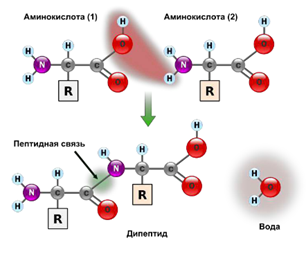
Рисунок 2 – Образование пептидной связи
Макромолекула кератина образуется большим количеством полипептидных цепочек, связь между которыми осуществляется за счет электровалентных (солевых), ковалентных и водородных связей, а также сил Ван-дер-Ваальса.
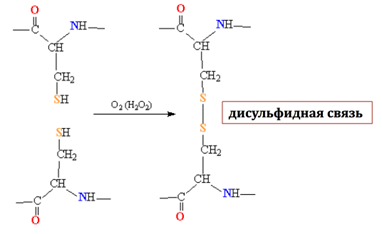
Рисунок 3 – Образование дисульфидной связи
Содержание серы в шерсти обусловлено наличием метионина и цистина. Последний в основном и определяет содержание серы в кератине. Эта кислота, содержащая дисульфидную связь, соединяет, как правило, две соседние пептидные цепи ковалентной дисульфидной связью, поэтому кератин является редкосшитым (сетчатым, трехмерным) биополимером (рисунок 3) [6]. Кератин один из немногих белков, содержащих цистин в большом количестве.
Наличие поперечных ковалентных связей делает кератин нерастворимым в воде и других полярных растворителях, обеспечивает наряду с другими элементами (наличие α – спирали, извитость волокна и др.) структуры формоустойчивости шерсти.
Гидрофобность кератина определяется содержанием в ним кислот: аланина, фенилаланина, валина, лейцина, изолейцина, т. е. аминокислот не содержащих полярные группировки. Эти гидрофобные кислоты определяют и некоторые трудности при смачивании шерсти.
Напротив гидрофильность кератина шерсти обусловлена наличием оксиаминокислот: серина, треонина, тирозина. Кислотные свойства кератина обусловлены наличием в нем дикарбоновых кислот: аспарагиновой и глутаминовой. Кислотные свойства кератина преобладают, как и у большинства белков, над основными не только потому, что в кератине несколько больше кислотных групп, а потому, что степень ионизации (рКСООН) карбоксильных групп большинства α – аминокислот больше степени протонирования аминогрупп (рКNH2). Эта избыточная кислотная ионизция компенсируется добавкой кислоты. Поэтому изоэлектрическая точка шерсти – 3,4 [7].
Кератин более устойчив к действию кислот, чем к действию щелочей. Слабые растворы кислот 4-5% концентрации не оказывают на шерсть заметного влияния. Однако азотная кислота оказывает очень сильное воздействие на шерсть. Она вызывает пожелтение шерсти. как любого другого белка [8].
Сильные щелочи даже при слабых концентрациях легко разрушают кератин, а кипячение образца шерсти в растворе NaОН приводит к его полному растворению. Воздействие щелочи на кератин вызывает разрушение дисульфидных связей [9].
Данный материал за счет содержания различных функциональных групп является перспективным сорбентом для очистки сточных вод промышленных предприятий и пищевых сред от ионов тяжелых металлов. К числу его достоинств можно отнести доступность, низкую стоимость, безопасность – является экологически чистым и биологически инертным по отношению к очищаемым средам [9].
Сорбция ионов тяжелых металлов кератином шерсти происходит, по мнению автора [10], в результате возникновения химической связи между функциональными группами кератина шерсти и ионами металлов.
Авторы [11] говорят о конкуренции между ионами металлов и ионами водорода в процессе сорбции, в [12] высказывается предположение, что происходит формирование комплексов между кератином шерсти и металлом (W/Cu(II)). Существует мнение, что металл вступает в реакцию с карбоксильными группами шерсти.
Отмечается, что механизм взаимодействия шерсти с водой остается до конца не выясненным [13]. Так, было установлено, что в процессе кипячения шерсти в дистиллированной воде до 20 % шерсти теряется, в том числе, в виде H2S. В большинстве случаев образование H2S и тиолов наблюдалось в водных растворах с высоким значением рН, чем с низким, что объясняется меньшей устойчивостью дисульфидных мостиков в щелочной среде. Однако существуют доказательства того, что эти соединения образуются также в нейтральной и слабо кислой среде. Механизм этих процессов до конца не выяснен, но высказываются предположения об образовании нестабильных интермедиатов при взаимодействии воды с дисульфидными фрагментами шерсти с последующим образованием H2S и тиолов. Оба эти соединения легко реагируют с Cu(II) с образованием комплекса Cu(I) с тиолами (WCH2SCu(I)) и сульфидов меди CuSx, где 1 < х < 2.
В работах [11-13] методом электронного спинового резонанса установлено, что соединения Cu(II) / W носят ионный характер.
В качестве наиболее предпочтительных центров сорбции, способных связывать ионы меди в условиях эксперимента, рассматриваются карбоксильные группы глутаминовой и аспарагиновой кислот шерсти [14]. При этом предполагается образование следующих структур [14]:
|
|
|
|
I |
II |
Рисунок 4 – Структуры сорбционных центров шерсти
Структура I может существовать как в складчатых, так и в развернутых участках протеиновой цепи шерсти. Формирование структуры II, представляющей собой межцепочечный комплекс, образованный ионами меди с карбоксильными группами разных протеиновых цепей осложнено в силу конформационных и стерических факторов. С другой стороны, если две СООН- группы двух соседних протеиновых цепей сближаются, структуры II может образоваться. Расчеты показали, что таких сближений возникает 50 на 1 г шерсти, что обусловливает связывание ионов Cu(II) карбоксильными группами кератина в количестве 150-300 mмоль/г шерсти.
Возможность образования такой структуры, в которой металл выступает по отношению к двум соседним протеиновым цепям в качестве «сшивающего агента», не ограничивается какой-либо конкретной конформацией белковой цепи. Однако важным фактором является то, что свободные карбоксильные группы более доступны в упорядоченных областях (складчатой структуре), чем в аморфных областях кератина шерсти. Кроме того, структура II характеризует электронейтральность, которая поддерживается между двумя анионными карбоксильными остатки и расположенным между ними катионом металла (II).
Изучив литературные данные по сорбции ионов тяжелых металлов различными растительными материалами, можно сделать вывод о том, что вторичные продукты переработки сельскохозяйственной, текстильной и деревообрабатывающей промышленности способны адсорбировать ионы металлов не хуже, чем промышленные сорбенты (активированные угли, иониты, цеолиты и другие). Широкий спектр методов модифицирования растительного сырья позволяет получать эффективные сорбенты, экологически чистые и биологически инертные по отношению к очищаемым средам.
Таким образом, выбор шерстяного волокна в качестве сорбента позволяет одновременно решить две задачи: очистку воды и утилизацию отходов текстильной промышленности.
Библиографический список
- Никифорова, Т.Е. Особенности сорбции ионов тяжелых металлов белковым сорбентом из водных сред / Т.Е. Никифорова, В.А. Козлов, М.В. Родионова // Журн. Прикл. Химии. – 2010. – Т. 83, Вып. 7. – С.1073-1078.
- Wan Ngah W. S. Removal of heavy metal ions from wastewater by chemically modified plant wastes as adsorbents: A review // Bioresource Technology. 2008. Vol. 99. Р. 35 – 48.
- S. Daneshfozoun, M.A. Abdullah, B. Abdullah. Preparation and characterization of magnetic biosorbent based on oil palmempty fruit bunch fibers, cellulose and Ceiba pentandra for heavy metal ions removal// Industrial Crops & Products 105 (2017) 93–103.
- Александер, П.В. Физика и химия шерсти. Пер с англ. / П. В. Александер, Р. Ф. Хадсон.- М.: Химия, 1958. – 288 с.
- Савостицкий Н. А. Материаловедение швейного производства : учебник для студ. учреждений сред. проф. образования / Н. А. Савостицкий, Э.К.Амирова. — 7-е изд., стер. — М. : Издательский центр «Академия», 2013. — 272 с.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. Пер. с англ.-М.: Мир, 1985.-367 с.
- Моррисон Р., Бойд Р. Органическая химия. Перевод с англ. М.:”Мир”, 1974. – 1133 с.
- Александер П., Хадсон Р. Ф. Физика и химия шерсти. М: – 1985–58 с.
- Е. Л. Пехташева, А. Н. Неверов, Г. Е. Заиков, В. И. Бутовецкая. Биоповреждения лубяных, искуственных и синтетических волокон. Вестник Казанского технологического университета, выпуск № 8 / том 15 / 2012.
- A. Rippon, D.J. Evans. Improving the properties of natural fibres by chemical treatments// CSIRO Materials Science and Engineering, Australia
- Simpson, W.S., Mason, P.G.R. // Textile Res. J. 1969. P. 434-441.
- Mendoza-Castillo DI , Rojas-Mayorga CK , Garcia-Martinez IP , Perez-Cruz MA , Hernandez-Montoya V , Bonilla-Petriciolet A , et al. Removal of heavy metals and arsenic from aqueous solution using textile wastes from denim industry. Int J EnvironSciTechnol 2015;12:1657–68.
- Нагимуллина Г.Р., Шайхиев И.Г., Шмыков А.И., Фридланд С.В. Очистка сточных вод, части ионы Co2 +, Ni2 +, Zn2 +, отходами валяльно-войлочного производства / Безопасность жизнедеятельности. 2008. № 12. С. 32-36.
- Fukatsu K. Formation of Copper(I1)-Woo1 Keratin Complexes // Textile Res. J. 1988. P. 91-96.