Введение
Известно что, в настоящее время одной из наиболее распространённых патологий щитовидной железы (ЩЖ) млекопитающих являются её дисфункция – гипотиреоз (ГПТ) – клинический синдром, вызванный длительным, стойким недостатком тиреоидных гормонов (ТГ) в организме, сопровождающийся снижением их биологического эффекта на тканевом уровне [1]. Имеются тяжёлые осложнения, такие как кретинизм, сердечная недостаточность, выпот в серозные полости, вторичная аденома гипофиза. Наиболее часто ГПТ развивается в исходе аутоиммунного тиреоидита, реже – после резекции ЩЖ и терапии радиоактивным 131I. Большую редкость представляет ГПТ, развившийся в исходе подострого, фиброзирующего и специфических тиреоидитов, а также стойкий ГПТ в результате лечения диффузного токсического зоба тиреостатиками. Можно выделить врождённые и приобретенные формы ГПТ. Причиной врождённого ГПТ, встречающегося с частотой 1 случай на 4-5 тысяч новорожденных являются: аплазия и дисплазия ЩЖ, эндемический зоб, врождённый дефицит ТТГ, синдром периферической резистентности к ТГ – казуистика [2]. Несмотря на такую распространённость, ГПТ часто длительное время не выявляется. Это отчасти обусловлено тем, что заболевание имеет постепенное начало и стертые неспецифические симптомы, которые расцениваются вначале как результат переутомления, других заболеваний, беременности. Гормоны ЩЖ регулируют энергетический обмен в организме и при ГПТ замедляются все обменные процессы. ГПТ может сопровождаться малокровием – анемией. Это придает коже бледный и слегка желтоватый оттенок. При ГПТ повышается уровень холестерина в крови, что может способствовать развитию атеросклероза. У большинства женщин с ГПТ наблюдается расстройства менструальной функции, у мужчин – эректильная дисфункция. Лицам, страдающим ГПТ, необходимы витамины, минералы, аминокислоты, полиненасыщенные жирные кислоты, про-биотики/пребиотики, клетчатка, ферменты, органотерапия, лекарственные растения и ортомолекулярные комплексы [3]. Этиологическое лечение ГПТ возможно далеко не всегда и почти неэффективно. В редких случаях этиологическое лечение может оказать положительный эффект. Так своевременная противовоспалительная терапия при инфекционно-воспалительном поражении гипоталамо-гипофизарной области может привести к восстановлению тиреотропной функции гипофиза. Обратимым может быть лекарственный ГПТ [4 – 6].
Гормоны ЩЖ – ТГ: Т3 и Т4 играют важную роль в деятельности ряда жизненно важных функций организма, в частности, в регуляции обмена веществ путём стабилизации внутренней среды живого организма. Немаловажная роль принадлежит гормонам ЩЖ влияющим непосредственно на деятельность нервной клетки, как, например, на её транспортные системы, на молекулярные механизмы клеточной деятельности, а также на центральную нервную систему в целом в период её развития. Характерной особенностью ТГ является присутствие в их молекуле в качестве обязательного компонента йода, регулярно поступающего в организм с пищей и водой в виде йодидов, которые в дальнейщем подвергаются окислению до йода. Последний включается в молекулу белка, образуя монойодтирозины и дийодтирозины. Конденсация двух молекул дийодтирозина с потерей одного остатка – аланина приводит к образованию ТГ: Т4, а при соединении молекулы дийодтирозина с молекулой монойодтирозина образуется ТГ: Т3. При нормальном функционировании ЩЖ располагает большим запасом органического йода в результате чего её функция может длительно осуществляться нормально, даже при недостатке поступления йода из внешней среды. Однако в случае длительного дефицита йода в организме нарушается нормальное функционирование ЩЖ, приводящее к блокаде синтеза ТГ, что является причиной развития ГПТ-статуса со всеми последующими негативными последствиями (нарушение окислительных процессов и минерального обмена, и, прежде всего, обмена хлоридов; снижение синтеза белков и процессов обмена углеводов и жиров и др.). Известно также, что многие явления, возникающие как следствие недостатка гормонов ЩЖ, могут быть устранены введением йодидов и ТГ [7].
Тиреотропный гормон гипофиза (ТТГ) – гликопротеидный гормон, стимулирующий образование и секрецию гормонов ЩЖ (Т3 и Т4). Вырабатывается передней долей гипофиза, по химическому строению является гликопротеидным гормоном. Анализ крови на ТТГ – необходимый этап в диагностике заболеваний ЩЖ, показывающий отклонение от нормы: ТТГ – пониженный или повышенный ТТГ. Если результат гормонального анализа – пониженный, это дает врачу повод заподозрить ГПТ, тяжелые психические заболевания, недостаточность функции надпочечников, различные опухоли (опухоль гипофиза и др.). Повышенный ТТГ может возникать как следствие физической нагрузки и приема некоторых медицинских препаратов (противосудорожных средств, рентгеноконтрастных средств и др.). Низкий ТТГ может быть признаком гипертиреоза, травмы гипофиза, снижения функции гипофиза. Анализ помогает выявить скрытый ГПТ, зоб, миопатию, депрессию, бесплодие, импотенцию и снижение либидо, гиперпролактинемию [8].
Исходя из рассмотрения системы нейроэндокринной регуляции клетки, известно, что данную систему помимо ТГ и стероидных гормонов, составляют также нейромедиаторы (НМ), одним из которых является ацетилхолин (АХ), являющийся одним из эфиров холина [9]. Исследования [10] свидетельствуют о том, что в коррегировании соматических и нейрогенных нарушений невторостепенна роль эфиров и амидов холина, заслуживающих существенного внимания с точки зрения особенностей их синтеза и биологической активности. Вместе с тем продолжают отсутствовать сведения относительно действия эфиров и амидов холина на изменение показателей ТТГ, общего Т3 и Т4 в крови у крыс различных возрастных групп при патологиях ЩЖ типа ГПТ. Учитывая вышесказанное, нами, в данных сериях научных исследований проведено изучение действия холинового эфира N-(4-бромбензоил)-α,β-дегидрофенилаланина, относящегося к эфирам холина, на изменение показателей ТТГ, общего Т3 и Т4 в крови у двенадцатимесячных крыс при экспериментальном ГПТ.
Материал и методы
Исследования проведены на 50 двенадцатимесячных крысах-самцах (линии Вистар, массой 230 – 250 г.), так как они удобны для массовых экспериментов и у них по сравнению с собаками, кошками, кроликами отмечается большая интенсивность физиологических показателей, протекающих в значительно более короткие промежутки времени, что является весьма приемлемым для ближайших и в особенности отдалённых наблюдений, связанных с изучением состояния восстановительных процессов. ГПТ вызывался путём проведения тиреоидэктомии. Тиреоидэктомия осуществлялась по следующему алгоритму. Для проведения операции крысы под эфирным наркозом фиксировались в положении на спине. Доступ к ЩЖ осуществлялся через разрез кожи в области шеи длиной около 3,5 – 4 см. Затем обнажалась ЩЖ, производили отпрепаровку 2/3 её части с сохранением паращитовидных желёз и с помощью острых ножниц доли отсекались, после чего под каждую из них подводились лигатуры. Раны послойно зашивались. Животные хорошо переносили операцию и спустя 0,5 – 1 час после операции подходили к корму и воде. Тиреоидэктомия в данных сериях экспериментальных исследований была проведена у 40 крыс. Животные были разделены на 3 подопытные группы: 1) интактные животные – 10 экземпляров; 2) животные с ГПТ, не получавших каждодневных инъекций холинового эфира N-(4-бромбензоил)-α,β-дегидрофенилаланина (ХЭФ) – 10 экземпляров; 3) животные с ГПТ, получавшие ХЭФ в дозе 200 мкг/кг массы тела в течение 14 дней – 30 экземпляров.
После тиреоидэктомии и окончания дачи ХЭФ у всех 50 крыс была проведена декапитация и сбор крови. В сыворотке с помощью иммуноферментного метода определялась концентрация ТТГ, общего Т3 и Т4.
Полученные данные подвергались статистической обработке в системе Statistica for Windows, с применением распределения Пуассона и критерия Пирсона.
Результаты и обсуждение
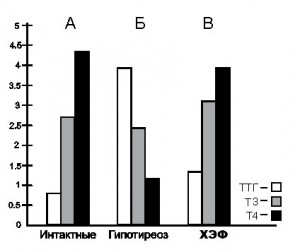
- Рис.1. Особенности изменения концентрации тиреотропного гормона гипофиза и тиреоидных гормонов в крови у двенадцатимесячных крыс в норме (А), при гипотиреозе (Б) и после действия холинового эфира N-(4-бромбензоил)-α,β-дегидрофенилаланина (В). Концентрация тиреотропного гормона гипофиза выражена в мМЕ/мл; трийодтиронина в нг/мл; тироксина в мкг/мл.
Тиреоидэктомия у крыс 2 подопытной группы приводила к возникновению у них характерных сдвигов в содержании ТТГ и ТГ в крови, которые отражали возникновение у них состояния ГПТ. Как видно на рисунке 1, Б – тиреоидэктомия приводила к шестикратному повышению содержания ТТГ (на 600 %) в сыворотке крови у крыс данной подопытной группы; содержание общего Т3 понижалось на 84, 6 % по сравнению с интактными животными (рис. 1, А); содержание же общего Т4 понижалось на 90, 6 %, соответственно. После введения ХЭФ в дозе 200 мкг/кг массы тела в течение 14 дней у крыс 3 подопытной группы были отмечены следующие показатели: содержание ТТГ в крови составило 171,4 % по сравнению с нормой принятой за 100 % (рис. 1, А); содержание общего Т3 составило 107,6 %; содержание общего Т4 составило 86, 0 % (рис. 1, В).
Полученные данные свидетельствуют о том, чти применение ХЭФ в данной дозе значительно снижало содержание ТТГ, Т3 и Т4 у гипотиреоидных двенадцатимесячных крыс, однако, вероятно, в дальнейшем целесообразно исследование более низких доз ХЭФ в данной возрастной группе. В случае ТТГ – после применения данной дозы ХЭФ показатели превышали норму на 71, 4 %; в случае Т3 – наблюдалось превышение показателей на 7, 6 %; в случае же Т4 – показатели практически подходили к норме.
Полученные результаты могут быть учтены в клинической практике, при прогнозировании течения и исхода функционального восстановления у лиц с патологией ЩЖ, такой, как ГПТ. Представленный анализ недавних изучений нейропротекторных агентов, антиоксидантов, стволовых клеток, вакцин, различных хирургических техник позволяют заключить, что нужны новые эффективные средства для лечения экспериментальной патологии ЩЖ крыс типа ГПТ [9]. Несмотря на интенсивные исследования, следует отметить фактическую безуспешность современных достижений при попытках терапии специфического заболевания ЩЖ типа ГПТ, как правило, приводящего к тяжелой инвалидизации. С учётом мультифакторной и мультифазной модели развития патологий ЩЖ, таких как ГПТ, эффективным может стать нейропротекторная стратегия терапии синтетическими производными холина, типа ХЭФ [10].
Библиографический список
- Carter C. R., Cao L., Cawai H., Smith P. A., Dryden W. F., Raftery M. A., Dunn S. M. Chain length dependence of the interactions of bisquaternary ligands with the Torpedo nicotinic acetylcholine receptor. J. Biochem. Pharmacol., 2007, № 73, v. 3, pp. 417 – 426.
- Behrend E. N. Update on drugs used to treat endocrine diseases in small animals. J. Vet. Clin. North. Am. Sm,all. Anim. Pract., 2006, № 36, v. 5, pp. 1087 -1105.
- Bottcher C., von Roepenack – Lahaye E., Schmidt J., Clemens S., Scheel D. Analysis of phenolic choline esters from seeds of Arabidopsis thaliana and Brassica napus by capillary liquid chromatography/electrospray- tandem mass spectrometry. J. Mass spectrum., 2009, № 44, v. 4, pp. 466 – 476.
- Eibl K. H., Lewis G. P., Betts K., Linberg K. A., Gandorfer A., Kampik A., Fisher S. K. The effect of alkylphosphocholines on intraretinal proliferation initiated by experimental retinal detachment. J. Invest. Ophtalmol. Vis. Sci., 2007, № 48, v. 3, pp. 1305 – 1311.
- Maestro B., Gonzalez A., Garcia P., Sanz J. M. Inhibition of pneumococcal choline-binding proteins and cell growth by esters of bicyclic amines. J. FEBS, 2007, № 274, v. 2, pp. 364 – 376.
- Sarda A. K., Kapur M. M. Thyroid surgery in an area of iodine deficiency. J. Head Neck., 2005, № 27, v. 5, pp. 383 – 389.
- Ma Q, Kuang A. Advance of researches on thyroid tissues autotransplantation and embryonic stem cell transplantation in therapy of hypothyroidism. J. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi., 2008, № 25, v.5, pp. 1212 – 1230.
- Ogbera A. O., Ekpebegh C., Eregie A., Kuku S. F. The role of radioactive iodine usage in the management of thyroid disorders with emphasis on sub-Saharan Africa. West Afr. J. Med., 2008, № 27, v. 4, pp. 211 – 217.
- Lania A., Giavoli C., Ferrante E., Beck-Peccoz P. Central hypothyroidism and growth hormone treatment: clinical care. J. Endocrinol. Invest., 2008, 9 Suppl, pp. 66 – 70.
- Scarpa V, Kousta E, Tertipi A, Vakaki M, Fotinou A, Petrou V, Hadjiathanasiou C, Papathanasiou A. Treatment with thyroxine reduces thyroid volume in euthyroid children and adolescents with chronic autoimmune thyroiditis. J. Horm Res Paediatr., 2010, № 73, v. 1, pp. 61 – 67.
