Клиническое исследование лекарственного препарата для медицинского применения представляет собой процесс изучения (научную практику) по выявлению свойств исследуемого препарата, влияющих на здоровье человека, а также эффективности или побочных эффектов от его применения или взаимодействия с другими лекарственными средствами [1].
Клинические исследования лекарственных препаратов проводятся для государственной регистрации лекарств, которые будут применяться в медицинских учреждениях Российской Федерации. Для утверждения лекарственного препарата и попадания его в реестр официально разрешённых необходимо пройти государственную процедуру получения профильной лицензии (разрешения) на исследования.
Министерство здравоохранения Российской Федерации 19 января 2018 года утвердило административный регламент по предоставлению государственной услуги по выдаче разрешения на проведение клинического исследование лекарственного препарата для медприменения. Данный приказ определяет сроки и порядок получения госуслуги, а также круг заявителей, которые могут претендовать на разрешение, должных ответственных лиц. Вся последовательность административных процедур, в основном, осуществляется через единый портал государственных и муниципальных услуг, как основной электронной площадки по получению документов, лицензий и разрешений.
Административный регламент закрепляет порядок получения государственной услуги по выдаче разрешения. Для этого первоначально определяется круг заявителей, которые могут претендовать на него. К ним относятся:
- сам разработчик лекарственного препарата или уполномоченное им лицо,
- высшие учебные заведения или учреждения дополнительного профессионального образования,
- организации научных исследований.
Для получения разрешения на проведение исследования препаратов, которое выдаёт Министерство здравоохранения РФ, необходимо предоставить список документов от заявителя [2]:
- заявление, определённое приложением №1 Административного регламента,
- копии документов, подтверждающих оплату госпошлин на проведение различного вида эскпертиз (все виды экспертиз определены Административным регламентом),
- протокол проведения клинического исследования,
- брошюру человека или группы лиц, проводящих исследование,
- информационный листок пациента, в отношении которого будут проводиться клинические исследования,
- документы, подтверждающие опыт работы исследователей, соответствие их необходимой специальности, которая разрешает проводить клинические исследования лекарственных препаратов.
- полная информация о той медицинской организации, в которой исследователи будут проводить исследование лекарств (полное и сокращенное наименования, организационно-правовая форма, место нахождения и место осуществления деятельности, телефон, телефакс, адрес электронной почты каждой медицинской организации),
- информация о приблизительных, желательно, точных сроках проводимого исследования,
- копию договоров обязательного страхование пациентов, которые будут участвовать в клиническом медицинском исследование лекарственных препаратов,
- полную информацию о химическом составе препаратов, применяющихся в исследовании,
- документ от производителя лекарства, полностью описывающий характеристики данного препарата и его медицинское применение,
- копию документов, подтверждающих лицензированность производства лекарственных препаратов на территории Российской Федерации.
Перечень документов принимается или в электронном виде, или с личной подачей. В случае подачи документов лицом иностранного государства, у которого все вышеперечисленные бумаги сделаны на иностранном языке, необходимо перевести их на русский язык и нотариально заверить.
Есть документы, которые принимаются в нескольких экземплярах. Так, протокол клинического исследования и брошюра исследователя подаются в двух экземплярах для получения разрешения на исследование и разрешения на этическую экспертизу. Документы, которые ранее были испорчены или полностью утрачены, предоставляются в виде копии или испорченного оригинала.
Предоставляемая государственная услуга имеет отличительную особенность среди всего огромного перечня госуслуг. У неё, в соответствии с регламентом, не имеется основания для отказа в приёме документов на получение разрешения на проведение клинического исследования лекарственных препаратов [1].
Перечень документов, которые поступили в Министерство от заявителя регистрируются в Департаменте управления делами и кадров Министерства в течение 1 рабочего дня с даты их поступления.
После приёма документов на получение соответствующего разрешения комиссия экспертов начинает проверку полноты предоставленных документов и достоверности информации в них. Если перечень документов представлен не в полном объеме или не в заявленный срок, или отсутствуют документы, подтверждающие оплату госпошлины, то экспертная комиссия вправе отказать или временно приостановить получение государственной услуги. Своё решение эксперты отправляют заявителю соответствующим письмом от лица профильного Министерства.
После успешного прохождения проверки комиссия формирует и направляет межведомственные запросы в госорганы, которые в дальнейшем будут предоставлять государственную услугу.
Далее эксперты принимают решение об успешном удовлетворении обращения или же об отказе в получении разрешения на проведения исследований. В обоих случаях после этого специалисты выдают дубликат разрешения (отказа) на проведение клинических исследований лекарственных препаратов.
В случае отказа заявитель может подать жалобу на имя Министра здравоохранения Российской Федерации в письменной или электронной формах, которая будет рассмотрена в течение пятнадцати рабочих дней. После этого заявителя проинформируют о результатах принятия решения.
Такой Административный регламент получения разрешения на проведение клинических исследований лекарственных препаратов контролируется ответственными должностными лицами Министерства здравоохранения РФ, которые проводят плановые и внеплановые проверки соблюдения законодательства в плане качества предоставляемой государственной услуги.
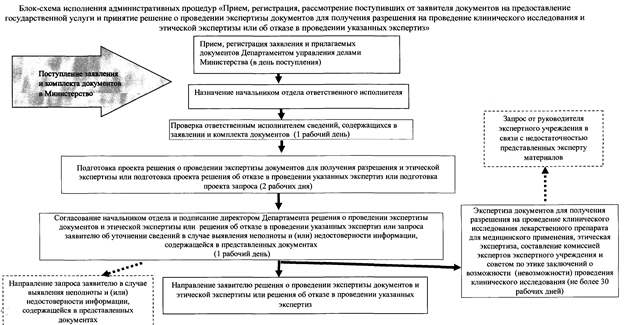
Утверждённый Административный регламент получения государственной услуги раскрывает её сущность через официальную блок-схему, то есть алгоритм, по обращению заявителя и дальнейшей судьбе его обращения.
Таким образом, главной особенность предоставления государственной услуги по получению разрешения на проведение клинических исследований лекарственных препаратов для медицинского применения является удобный электронный формат, позволяющий заявителю, в лице физического или юридического лица, через онлайн-сервисы в весьма короткие сроки получить госуслугу. Слаженная работа специалистов по разработке электронной платформы даёт возможность не только эффективно использовать государственный ресурс, но удовлетворять запросы общества на максимально быстрое получение документов осуществление данного и иных видов деятельности.
Библиографический список
- Административный регламент Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по выдаче разрешения на проведение клинического исследования лекарственного препарата для медицинского применения, утверждённый приказом Министерства здравоохранения Российской Федерации от 19 января 2018 г. № 20н // https://www.garant.ru/products/ipo/prime/doc/71818656/#1044/ (дата обращения 18.06.2019)
- Федеральный закон от 12 апреля 2010 N 61-ФЗ “Об обращении лекарственных средств”
(ред. от 04.06.2018) // http://www.consultant.ru/document/cons_doc_LAW_99350/ (дата обращения 18.06.2019) - Федеральный закон от 27 июля 2010 г. № 210-ФЗ “Об организации предоставления государственных и муниципальных услуг” // https://www.garant.ru/products/ipo/prime/doc/71818656/#1044/ (дата обращения 17.06.2019)
