Железо-фосфорные сплавы состоят из фосфидов железа и твердых растворов фосфора в железе. В промышленности широко известным продуктом является феррофосфор (технический фосфид железа) используемый в качестве раскислителя в черной металлургии. В довольно значительных количествах он образуется и при электротермическом производстве желтого фосфора. Но использование этого феррофосфора в качестве раскислителя встретило значительные трудности из-за повышенного содержания кремния и некоторых других примесей, а также из-за непостоянства состава. Поэтому был предложен ряд технологии его переработки на различные фосфаты, среди которых имеются и электрохимические методы [1-3].
Разработаны также химические и электрохимические способы получения сплавов железо-фосфор в качестве функциональных покрытий [4-6].
По своим физико-химическим свойствам феррофосфор относится к группе веществ, определяемых понятием “твердые металлы”. Это вещества металлического характера, обладающие высокой твердостью, высокой температурой плавления, высокой тепло – и электропроводностью, а также хорошей устойчивостью к химическому воздействию [2,7].
Для изучения электрохимического поведения фосфидов были использованы сплавы, полученные ампульным методом из особо чистых
порошков металла и красного фосфора при помощи самораспространяющегося высокотемпературного синтеза. Исследуемые металлфосфорные сплавы (S=5 мм2), выполнялись в виде дискового электрода и вставлялись в полихлорвиниловую трубку. Применение такой изоляции исключает ввод изолирующих замазок, которые могут быть причиной загрязнения электролита. Ток к аноду подводился через впаянную к феррофосфорному диску медную проволоку. Анод перед каждым опытом тщательно обрабатывался наждачной бумагой возрастающих номеров, очищался смесью Эшка, декапировался 5%-ным раствором серной кислоты, многократно промывался дистиллятом.
Вольтамперные измерения проводились при температуре 25 оС в потенциодинамическом режиме на потенциостате
ПИ-50-1.1. Скорость развертки потенциала составляла 0,01 мВ/сек. Электролизером в потенциоинамических исследованиях служила трехэлектродная стеклянная ячейка. В качестве вспомогательного электрода использовали платиновую пластинку с поверхностью 0,4×10-3 м2. Электродом сравнения служили хлорсеребряный электрод. Все потенциалы приведены по водородной шкале. Воспроизводимость результатов в активной области потенциалов составляла ±10 мв. В пассивной области потенциалов воспроизводимость ухудшалась и составляла ±(10-50) мв. Исследуемые растворы готовились на бидистиллированной воде из реактивов марки “хч”.
Измерения проводились также гальваностатическим методом с использованием высокоомного потенциометра Р-307. В качестве катода использовалась платиновая пластинка (S=2см2). Сила тока в цепи контролировалась многопредельным амперметром М-253, с классом точности 0,5.
Кроме того, при различных плотностях тока по общепринятым методикам проводили анализ основных продуктов электролиза[8].
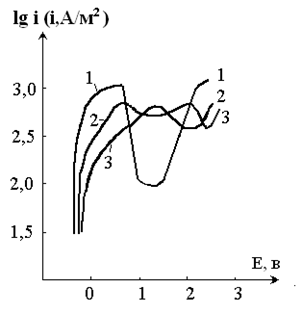
На рисунке 1 представлены результаты потенциодинамических исследований железо-фосфорного сплава (20,0 и 27,0 масс.% P) в 1,0 М растворе Н2SO4. Для сравнения, показаны кривые поляризации для стали З, электрохимическое поведение, которого близко к железу. При этом наблюдаются следующие различия.
1.При любом потенциале активной области железо-фосфорные сплавы имеют более низкий ток растворения.
2. Переход к пассивному состоянию для железо-фосфорного сплава происходит при плотности тока меньшей, чем для чистого железа, однако, критический потенциал для пассивации железо-фосфорных сплавов примерно на 200 – 250 мв более положителен, чем для железа.
З. Для железо-фосфорных сплавов не наблюдается глубокая пассивация, что характерно для чистого железа в сернокислой среде.
В соответствии с данными [9-11], скорость анодного растворения железа катализируется ионами гидроксида при всех значениях рН. Для кислых растворов, концентрация ОН - чрезвычайно мала, однако, если учитывать специфическую адсорбцию ОН - ионов на поверхности металла, то количество находящихся в растворе ионов ОН
- не имеет значения, так как адсорбированные ионы ОН -адс могут образовываться из адсорбированных молекул воды по реакции
Н2Oадс → OH -адс + H+ (1)
На поверхности железа сначала образуются соединения FeOH в результате реакции между атомами железа в кристаллической решетке и адсорбированными ОН- ионами
Рисунок 1. Анодные потенциодинамические кривые железо-фосфорных сплавов в 1,0 М растворе серной кислоты
Обозначение кривых по содержанию фосфора (масс. %) в сплаве: 1 – 0; 2 – 20,0; 3 – 27,0.
Fe+ OH - адс → Fe(OH) + ē (2)
FeOHадс + Fe + OH -адс → FeOH+ + 2 ē (3)
Перенос заряда осуществляется через FeOH+, который распадается в кислом растворе
FeOH+ + H+ → Fe2+ + H2O (4)
На потенциалы образования этих соединений, видимо, фосфор не оказывает влияния. Однако растворение фосфора может происходить в области потенциалов независимо от растворения железа, что термодинамически вполне вероятно [9].
Поэтому при анализе вольтамперных кривых железо-фосфорных сплавов, наряду с вышеприведенными процессами для железа необходимо учитывать и протекание возможных параллельных реакции фосфора со средой, а также с ионами железа. Такое предположение не противоречить литературным данным. Согласно [10] при поляризации фосфор-, борсодержащих сплавов при активной области наблюдается значительное обогащение предпассивных пленок продуктами окисления этих элементов.
Следовательно, надо полагать, что фосфор участвует в образовании предпассивной пленки в активной области, однако состояние окисления не известно. В активной области, к потенциалу растворения железа с образованием двухвалентных ионов (Eо= -0,44 В), близко по термодинамическому значению реакция окисления фосфора:
P + 3H2O → H2PO-3 + 4H+ + 3 ē, Eо= -0,46 B (5)
Образование H2PO-3 и перенос заряда, по всей вероятности, осуществляется через FeOHадс, который взаимодействует с активным фосфором по реакции
3FeOHадс + P → H2PO-3 + 3Fe2+ +H+ + 6 ē. (6)
Бóльшая поляризация железо-фосфорных сплавов в активной области по сравнению с чистым железом, может быть связана со многими факторами. Как отмечено в [9], при анодном окислении металлов из твердой фазы наклон тафелевских прямых не всегда согласуется с теорией замедленного разряда, поскольку здесь поляризация обусловлена преимущественно затратой энергии на разрушение кристаллической решетки. Это соображение, по-видимому, справедливо и для анодного растворения металлфосфорных сплавов, состоящих из нескольких фаз, которые влияют на закономерности электрохимической кинетики. При активно-пассивном переходе предпассивная пленка исчезает и замещается тонкой пассивной пленкой. Как было отмечено, переход к пассивному состоянию для железо-фосфорных сплавов имеет низкий ток, что обусловлено, видимо, нарастанием пассивной пленки на основе предпассивной пленки. Такой ход событий можно предположить следующими реакциями в области Фладе -потенциала
FeOHадс + H2PO-3 → H2PO-4 + Fe3+ + H+ + 2 ē, (7)
а в объеме раствора
2Fe3+ + H2PO-3 + H2O → H2PO-4 + 2Fe2+ + 2H+ (8)
В этих случаях становится возможным образование пассивирующих пленок непосредственно на поверхности, а также их отложение из объема раствора в результате взаимодействия ионов железа и фосфат ионов.
Сравнение вольтамперных кривых в области солевой пассивации (предшествующей основной пассивации), показывает, что в случае фосфидов железа солевая пассивация наступает при более низких плотностях тока. При анодном растворении железа, солевая пассивация обусловлена образованием при повышенных плотностях тока пленки сульфата железа. В случае железо-фосфорного сплава в образовании солевой пленки участвуют наряду с сульфатами железа фосфаты и фосфиты железа, имеющие более низкую растворимость. Поэтому, в случае фосфидов железа, солевая пассивация наблюдается уже при низких плотностях тока. Также при повышении содержания фосфора в сплаве (рисунок 1, кривые 2,3), увеличивается доля фосфатов и фосфитов в солевой пленке, которая приводит к снижению плотности тока, начала образования солевой пассивации.
В области потенциалов, где железо находится в пассивном состоянии, скорость анодного процесса железо-фосфорного сплава будет зависеть от защитных свойств смешанных оксидно-фосфатных пленок. Возможно, в некоторых средах их защитные свойства могут быть очень высокими.
Известно, что железо не пассивируется в хлоридных электролитах. На рисунке 2 результаты поляризации железо-фосфорных сплавов в 2,0 М растворе соляной кислоты сравниваются с соответствующими данными чистого железа. Ход поляризационных кривых в активной области железо-фосфорных сплавов в 2,0 М HCl практически идентичен поведению их в серной кислоте. Этот факт позволяет предположить, что при растворении железо-фосфорных сплавов в присутствии хлорид ионов потенциалопределяющие процессы те же, что и в серной кислоте. Кроме того, при анодном окислении железо-фосфорных сплавов в 1,0 M H2SO4 и 2,0 M HCl на поверхности электрода образуются продукты, близкие по своей природе. В то же время в отличие от железа, на железо-фосфорном сплавах имеются площадки предельных токов. Здесь влияние фосфора на анодное поведение железа очевидно, поскольку в системе других влияющих факторов нет. Фосфаты железа по сравнению с хлоридами имеют гораздо более низкую растворимость, поэтому, вполне вероятно, что солевая пассивация электрода в случае железо-фосфорных сплавов будет иметь место при более низких плотностях тока. Наличие ионов хлора не делает возможным наступление глубокой пассивации, вследствие чего состояние пассивных пленок неустойчивое и поверхность сплава постоянно изменяется.
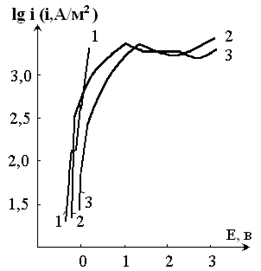
Рисунок 2. Анодные потенциодинамические кривые железо-фосфорных сплавов в в 2,0 М растворе соляной кислоты
Обозначение кривых по содержанию фосфора (масс. %) в сплаве:
1 – 0; 2 – 20,0; 3 – 27,0.
Влияние фосфорного компонента заметно и в нейтральных хлоридных растворах (рисунок 3). Здесь также наличие фосфора в сплаве увеличивает анодную поляризацию, возможно из-за более лучших пассивных свойств основных фосфатов железа по сравнению с оксидами или гидроксидами. При растворении фосфорсодержащих сплавов происходит образование кислородных соединений фосфора, которые связывают железо.
Однако при значительных содержаниях фосфора в сплаве часть кислородных соединений фосфора может оказаться несвязанной, что приведет к повышению кислотности среды. Такие изменения в прианодном слое может оказаться значительным и вызвать заметную деполяризацию анодного процесса.
Кроме того, при увеличении содержания фосфора вероятность образования в приэлектродном слое кислых солей возрастает.
Повышение содержания кислых солей ухудшает пассивирующие свойства солевой пленки. Этим двойственным влиянием фосфора и можно объяснить то, что при содержании фосфора 27 % наблюдается меньшая поляризация, чем при 20 %.
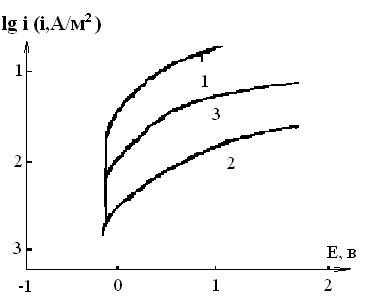
Рисунок 3.Анодные потенциодинамические кривые железо-фосфорных сплавов в 1,0 н растворе NaCl.
Обозначение кривых по содержанию фосфора (масс.%) в сплаве:
1 -0; 2 – 20,0; 3 – 27,0.
Гальваностатические кривые, представленные на рисунке 4, в сочетании с химическим анализом продуктов растворения (таблицы 1,2) показывают, что анодный процесс железо-фосфорного электрода в области образования ионов железа происходит с заметными затруднениями. При электролизе достигаются потенциалы окисления растворителя или компонентов электролита, выделяющиеся при этом газы, разрыхляя солевую пленку, предотвращают полную пассивацию анода.
Таблица 1
Суммарное содержание ионов железа разной валентности в продуктах анодного растворения железо-фосфорного сплава (20,0 масс.% Р)
Q = 10,0 А×ч. t=25 оC, концентрация электролита 1,0 моль/л.
|
Электролит |
ia ×10-4 А/м2 |
Убыль анода, г |
Количество железа в продуктах электролиза |
||||
|
Всего |
В т.ч. по Fe |
Fe(II) г |
Fe(II) % |
Fe(III) г |
Fe(III) % |
||
|
Серная кислота |
0,01 |
6,95 |
5,56 |
4,14 |
74 |
1,43 |
26 |
|
Серная кислота |
0,1 |
6,38 |
5,1 |
0,82 |
16 |
4,14 |
81 |
|
Соляная кислота |
0,01 |
6,6 |
5,28 |
3,92 |
74 |
1,38 |
26 |
|
Соляная кислота |
0,1 |
6,34 |
5,07 |
1,02 |
20 |
4,06 |
80 |
|
Сульфат натрия |
0,01 |
4,32 |
3,45 |
- |
- |
3,4 |
98 |
В пассивной области образуются преимущественно соединения трехвалентного железа и пятивалентного фосфора. Как видно из таблицы1, повышение плотности тока от 1,0×102 до 1,0×103 A/м2 увеличивает содержание трехвалентного железа примерно в четыре раза, как в сернокислом, так и в солянокислом электролите.
Значительная поляризация в нейтральных средах (рисунки 3 и 4) приводит к такому же результату. В продуктах электролиза обнаруживаются только фосфаты трехвалентного железа (таблицы 1,2). Кроме того, поляризация приводит к уменьшению выхода продуктов растворения железо-фосфорного сплава, облегчая выделение кислорода.
Таблица 2
Суммарное содержание ионов фосфора разной валентности в продуктах анодного растворения железо-фосфорного сплава (20,0 масс.% Р)
Q = 10,0 А×ч. t=25 оC, концентрация электролита 1,0 моль/л
|
Электролит |
ia ×10-4 А/м2 |
Убыль анода, г |
Количество фосфора в продуктах электролиза |
||||
|
Всего |
В т.ч. по Р |
P(III) г |
P(III) % |
P(V) г |
P(V) % |
||
|
Серная кислота |
0,01 |
6,95 |
1,39 |
0,03 |
2 |
1,37 |
98 |
|
Серная кислота |
0,1 |
6,38 |
1,28 |
0,03 |
2 |
1,24 |
98 |
|
Соляная кислота |
0,01 |
6,6 |
1,32 |
0,04 |
3 |
1,26 |
95 |
|
Соляная кислота |
0,1 |
6,34 |
1,27 |
0,03 |
2 |
1,26 |
99 |
|
Сульфат Натрия |
0,01 |
4,32 |
0,86 |
- |
- |
0,83 |
99 |
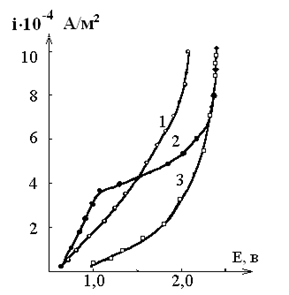
Рисунок 4. Анодные гальваностатические кривые железо-фосфорного сплава (20,0 масс.% Р) в кислых и нейтральных растворах
Обозначение кривых:
1 – в 2,0 М растворе HCl; 2 – в 1.0 M растворе H2SO4; 3 – в 1.0 M растворе Na2SO4.
Металлфосфорные сплавы железа изучались также в щелочной среде (2,0 М растворе КОН). Анодные потенциодинамические кривые (рисунок 5) показали, что в активной области анодный процесс на фосфорсодержащих электродах протекает в области потенциалов, близких к потенциалам чистого железа. Известно [9], что в щелочном растворе на поверхности железа происходит быстрое образование адсорбционных групп, содержащих гидроксид, взаимодействие которых с компонентами раствора приводит к ионизации и переходу в раствор поверхностных атомов, как железа, так и фосфора. В этом плане реакции, идущие в щелочном растворе, выгодно отличаются от реакций в кислой среде. Поэтому следует ожидать высокую скорость растворения железо-фосфорного сплава в щелочном растворе. Однако по мере роста потенциала ионы ОН - способствуют пассивации железа. По литературным данным [11], пассивация металлов обусловлена специфическими (химическими) силами поверхности. Состав поверхностных соединений в некоторых случаях может изменяться непрерывно, что имеет место при постоянном возрастании валентности металла в поверхностном соединении.
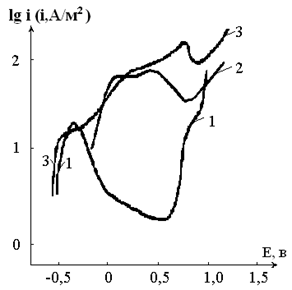
Рисунок 5. Анодные потенциодинамические кривые железо-фосфорных сплавов в 1,0 н растворе NaOH
Обозначение кривых по содержанию фосфора (масс.%) в сплаве: 1 -0; 2 – 20,0; 3 – 27,0.
В первые моменты времени (в активной области растворения) с увеличением потенциала скорость растворения железо-фосфорных электродов, как и железа, возрастает (рисунок 5), на кривой железа имеется четкий активно-пассивный переход. В пассивной области ход поляризационных железо-фосфорных сплавов и железа заметно отличаются. При потенциале 0,5 в скорость анодного процесса на железо-фосфорных электродах примерно на 1,5 порядка выше, чем на железном электроде.
Процесс в щелочных растворах в литературе достаточно хорошо описан [9,10] и в общем, виде реакции анодного процесса определяются уравнениями
Fe + 2 OH - = Fe(OH)2 + 2 ē, E= -0,87B (9)
Fe(OH)2 + OH - = Fe(OH)3 + ē, E= -0,56B (10)
Причиной пассивации железа связывают с образованием фазовых окислов железа типа Fe3O4 или Fe2O3.
Если под воздействием тока на электроде устанавливается определенный окислительно-восстановительный потенциал, то должно произойти навязывание этого потенциала и раствору через электрохимическое изменение концентрации окислительного и восстановительного компонентов раствора. В данном случае по [12] равновесные потенциалы систем Fe/Fe(OH)2, (-0,87 B) и Fe(OH)2/Fe(OH)3, (-0,56 B) имеют более положительные значения, чем стандартные потенциалы окисления фосфора в щелочных растворах.
P + 2 OH - = H2PO2 - – ē (Ео =- 2,05 B) (11)
Н2РО2 +3 OH - =HPO3 2- + 2 H2O +2 ē (Ео =- 1,56 B) (12)
HPO32- +3 OH - =PO3- 4 + 2H2O +2 ē (Ео =- 1,12 B) (13)
Фосфор и его недоокисленные оксианионы могут мешать пассивации тем, что окисляются на электроде и этим деполяризуют его (рисунок 5 кривые 2 и 3). Возрастание скорости растворения на железо-фосфорных электродах, очевидно, связано также с образование смешанных продуктов окисления железа и фосфора, пористого фосфатно-окисного покрывающего слоя. При отсутствии фосфора на поверхности железа образуется поверхностный окисный слой, без предварительного покрытия поверхности пористым солевым оксидом.
Библиографический список
-
Ван Везер, Фосфор и его соединения. – М.: ИЛ, 1962. -.687 с.
-
Корбридж Д. Фосфор. – М.: 1982. – 680 с.
-
Самсонов Г.В., Черногоренко В.Б., Мучник С.В. Современное состояние , перспективы исследования и применения фосфидов. // В кн.: Получение, свойства и применение фосфидов. Киев. Науково думка, 1977. – с. 5-6.
-
Способ электролитического осаждения сплава железо-фосфор / Серебровский В.И., Серебровская Л.Н., Коняев Н.В. и др.//Патент на изобретение №2164560, 2000. – 6 с.
-
Серебровский В.И., Гнездилова Ю. П. Электроосаждение бинарных сплавов на основе железа для упрочнения деталец машин // Вестник ОрелГАУ. 2009. №1. С.9-12.
- Ауешов А.П., Ескибаева Ш.З., Темирова С.С., Гинзбург М.А., Синяев В.А. Образование фосфидов при взаимодействии циклотрифосфата натрия с металлическим железом в условиях нагрева //Известия МН-ВО РК. Серия химическая. 1999, №2, с.3-9
-
Микаэлян А.С., Васильев В.Ю. Коррозионная стойкость фосфидов железа и хрома // VI Науково- технiчный семiнар по фосфору «Науковi матерiалзнавчi проблеми хiмiï фосфору його неорганiчних сполук» («Фосфор Украïни – 93») тези доповiдей.- Львiв, 1993 р. – С.81.
- Шкаровский Ю.Ф., Лынчак К.А., Черногоренко В.Б. Методы анализа фосфидов // В кн.: Получение, свойства и применение фосфидов.- Киев, 1977. – С. 76-88.
-
Кеше Г. Коррозия металлов. – М: Металлургия. – 1984. – 323
с. -
Каспарова О.В., Колотыркин Я.М. Влияние металлургических факторов на коррозионное и электрохимическое поведение конструкционных материалов. (обзор. докл. IX Межд. конф. Торонто, 1984) // Защита металлов. – 1985. – Т.21, № 6. – С. 860-861.
-
Cadet P., Keddam., Takenouti H. Electrochemical behavior of amorphous Fe-Cr-P allous in sulfiric acid.// Proc. Uth. Int. Conf. on Rapidly Quenched Metals (Sendei). –1981.- vol.2 – Р. 24-28.
-
Справочник по электрохимии. – Л: Химия, 1981. – 486 с.
Количество просмотров публикации: Please wait


